BIOMEMBRANAS

Estructura y propiedades de las membranas biológicas.
Características.
- Permeabilidad selectiva: papel activo en la diferenciación con el entorno permitiendo el paso de unas sustancias y rechazando otras.
- Acepción de energía en las células fotosintéticas.
- Reconocimiento celular (como en el caso antígeno - anticuerpo).
Estructura.
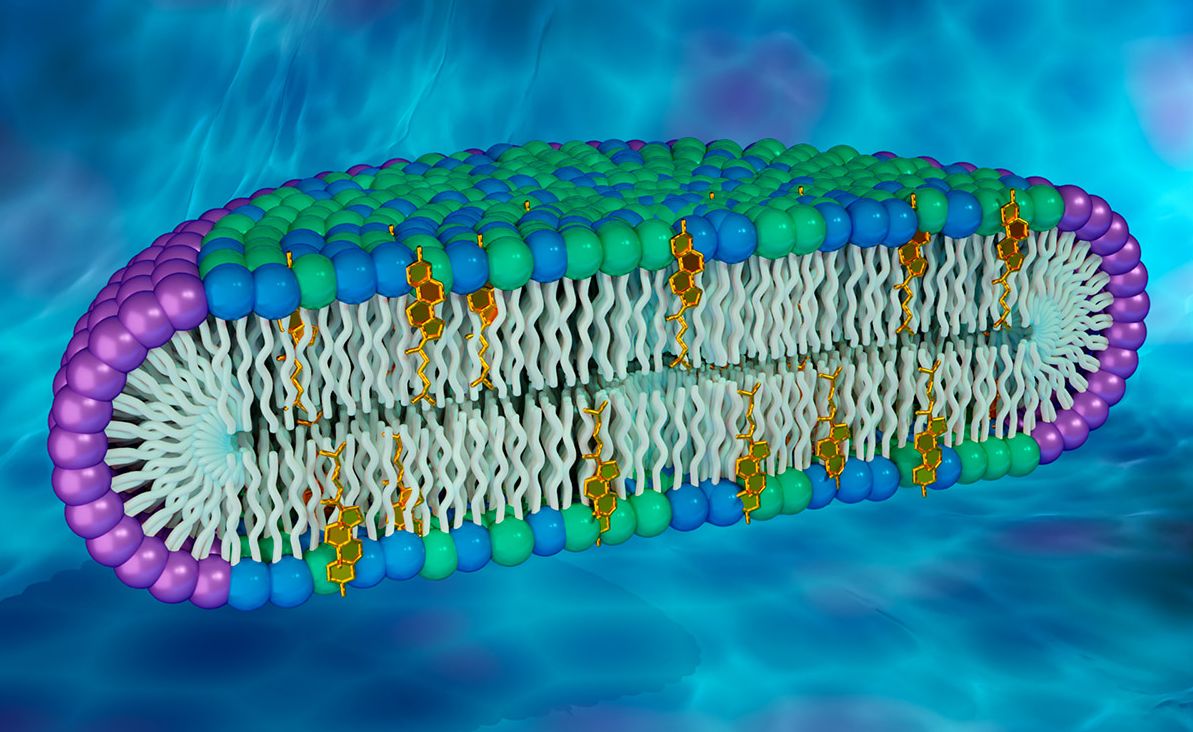
- Bicapa lipídica: mosaico fluido. El interior de la membrana es hidrofóbico gracias a las colas hidrocarbonadas.
- Hay proteínas dentro de la membrana o asociadas a ellas que dan las funciones. Hay membranas con muy alta proporción de proteínas.
Lípidos.
Hay de tres clases; han de tener componentes polares y apolares.
1.- Glicolípidos: tienen un grupo hidrato de carbono, glucosa, galactosa, monosacáridos ...
2.- Fosfolípidos: derivado del glicerol con dos cadenas hidrocarbonadas y un grupo fosfato con grupo polar. En entorno acuoso es estable en estructura bicapa.
3.- Esfingolípidos: derivados del alcohol esfingosina.
Esteroles.
Colesterol. Componente esencial, tiene un grupo OH polar y anillos hidrofóbicos.
Estructura bicapa.
Es estable porque las colas hidrofóbicas están dentro interaccionando para huir del entorno acuoso. Si la membrana está ordenada y todas las colas interaccionando, la estructura es muy organizada y se llama estructura rígida. No es la idónea para las funciones biológicas porque debe ser fluida. La estructura fluida se alcanza aumentando la temperatura. Hay una temperatura llamada de transición por debajo de la cual la estructura es rígida, y por encima fluida. Esta temperatura depende de las características de los lípidos que la forman: cuanto más larga sea la cola más rígida será, influenciada por el número de insaturaciones (mayor número, más fluida). El colesterol es esencial para la fluidez porque se introduce entre las colas y no deja que se organicen.
Proteínas de membrana.
Caracterizan la funcionalidad de la membrana. Hay 2 grupos:
- Proteínas solubles: se extraen fácilmente. Están asociadas débilmente a proteínas globulares (hidrofílicas). Algún residuo permite asociarse a la membrana. Algunas se asocian más permanentemente uniéndose de forma covalente a elementos hidrofóbicos. Las cadenas laterales de los aminoácidos reaccionan con un ácido graso que se inserta dentro de la membrana.
- Proteínas muy poco solubles inmersas dentro de la estructura de la membrana: hay que romper la membrana para extraerlas. La cadena polipeptídica les permite estar dentro por medio de fragmentos de 20 o 25 aminoácidos hidrofóbicos llamados transmembrana (estructura a hélice), la cantidad necesaria para atravesarla. Hay proteínas con 1 transmembrana y otras con 12. Si una proteína atraviesa muchas veces la membrana crea un canal de residuos polares que permite la entrada de moléculas polares.
Características de la membrana.
- Todos los lípidos y las proteínas se mueven dentro de la membrana (fluida). La movilidad lateral es indispensable para el funcionamiento, y la transversal resulta más dificultosa, lo que provoca asimetría.
- Hay hidratos de carbono que modifican las proteínas o lípidos. Oligosacáridos o glucosa en general.
- La membrana delimita un espacio cerrado con composición diferente. La parte intermedia es apolar, no permeable a iones (polares). Los apolares atraviesan la membrana.
Permeabilidad selectiva:
Sistema especial de transporte de moléculas polares e iones. Hay proteínas específicas transportadoras, algunas polares. El agua atraviesa las membranas sin dificultad.
- Las membranas son capaces de mantener gradientes iónicos. Como no pasan libremente, se puede establecer una diferencia de potencial a ambos lados de la membrana.
Transporte a través de membrana.
Aspectos termodinámicos.
El transporte de moléculas cuya concentración sea superior fuera requiere la aportación de energía.
D G’>0. Al revés es favorable y D G’<0, se desprende energía, que se acumula en forma de gradiente. Relacionado con la síntesis de ATP.
Si c2 es la concentración del interior de la célula y c1 la del exterior,
![]()
- Si la molécula transportada es neutra:
c2>c1 D G>0 es desfavorable, se ha de aportar energía.
c2<c1 D G<0 es favorable, se favorece la entrada y se desprende energía.
c2=c1 D G=0 está en equilibrio y no hay transporte.
- Si la molécula transportada está cargada: además del gradiente de concentración se ha de considerar el potencial eléctrico. D G depende de la carga y el potencial entre las partes:
![]() criterio de signos:
criterio de signos: ![]()
El transporte de moléculas cargadas con el mismo signo que las de dentro es desfavorable y si son de signo contrario no.
Normalmente influyen el gradiente de concentración y el potencial de membrana :
![]()
D G es la diferencia de potencial (gradiente) electroquímico, informa sobre el trabajo para transportar un ion o la energía que libera. Si D m <0 libera energía.
Normalmente se usa gradiente de protones para m ion:
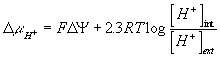 y como -log [H+]
= pH
y como -log [H+]
= pH ![]()
Mecanismos de transporte a través de membrana
- Transporte sin aporte de energía: transporte pasivo, ocurre cuando es a favor de gradiente.
- Transporte aportando energía: transporte activo.
- Difusión simple: las sustancias hidrofóbicas atraviesan libremente la membrana. Sólo pasivo. Moléculas solubles en la membrana y muy pequeñas, como el agua, oxígeno ...
- Difusión facilitada: por proteínas transportadoras. Activo. Es específico y se puede saturar, lo que depende de la cantidad de proteínas transportadoras. Si se satura es facilitado.
Tipos de transporte pasivo:
La proteína forma un canal polar que permite el paso de iones. Pasivo cuando es a favor de gradiente. Hay tres posibilidades:
- Canal con entorno polar que atraviesa la membrana.
- Hay moléculas transportadoras llamadas ionóforas que son solubles en la membrana. Como pasan libremente pueden unir un ion y soltarlo dentro cuando el gradiente aumenta.
- Hay proteínas integrales transportadoras que al unir un ion cambia su conformación y lo libera al otro lado, donde la concentración es más pequeña.
Tipos de transporte activo:
Sólo ocurre cuando hay transportadores. Requiere energía porque es contra gradiente
- Transporte activo primario: a la vez que el transporte se da una reacción química que aporta la energía necesaria. Ejemplos:
a.- Bomba de Na+-K+: se transportan Na+ y K+ al mismo tiempo que se hidroliza ATP.
b.- Acoplando transporte de H+ al transporte electrónico en contra de gradiente. La energía necesaria viene de la reacción redox del transporte de electrones.
Transporte activo secundario: la fuente de energía necesaria para el transporte proviene de otro sistema.
Estos dos tipos de transporte hacen referencia a la dirección del transporte iónico, cotransporte si van en la misma dirección y antitransporte si van en direcciones contrarias. El aporte energético viene dado casi siempre por la hidrólisis del ATP, ya que es en contra de gradiente. Un sistema enzimático en la membrana, la ATPasa , transportará Na+ y K+ a través de la membrana,
La ATPasa se encarga de mantener la diferencia de potencial. Saca 3 Na+ y mete 2 K+. Otro sistema aprovecha la vuelta del Na+ a favor del gradiente creado por la ATPasa. Esta energía es aprovechada para el transporte de glucosa en contra de gradiente.
Teoría quimiosmótica
La síntesis de ATP desde la fosforilación oxidativa siempre está asociada a una membrana que debe tener ATP sintasa y transporte de electrones. La fuente de energía para la síntesis de ATP es un transporte de iones a favor de gradiente y la encargada será la ATP sintasa. El gradiente será de H+. La cadena de transporte está acoplada al bombeo de H+. La ATP sintasa es un sistema reversible, cuando hay gradiente de H+ sintetiza ATP y cuando no lo hay utiliza la hidrólisis del ATP para crearlo. Las membranas han de ser impermeables a los H+ para crear el gradiente, que se usa para otras cosas, como cotransporte, producción de calor para aumentar la temperatura ...
ATP sintasa.
Sistema enzimático que sintetiza ATP por fosforilaión oxidativa. Asociado a la membrana. La energía necesaria la aporta el gradiente de protones creado por la cadena de transporte electrónico, que está en la misma membrana. Cuando se transportan electrones se bombean protones creando un potencial electroquímico. Sólo se sintetiza ATP cuando existe este gradiente (síntesis acoplada al transporte de electrones). Los protones entran a favor de gradiente, pasan a través del complejo enzimático para volver y la energía liberada es usada.
La ATP sintasa tiene tres componentes:
- F1: atraviesa la membrana creando un canal para los protones. Está formada por 3 componentes: a, b y c. La que tiene mayor número de subunidades iguales es c. Alguna de sus componentes sobresale un poco para atraer F0.
- Porción catalítica donde se unen ADP + Pi à ATP
- F0: está fuera de la membrana y es hidrosoluble. Está en el lado de menos concentración de protones. Tiene 5 subunidades: a , b , g , d y e . Tiene 3 copias de a y b , y 1 de las otras. Sólo b tiene sitios activos para la síntesis de ATP (3). Los sitios interaccionan funcionando de manera alternada. Cada sitio pasa `por 3 estados: unir, formar y soltar ATP. g hace de puerta para los protones. Es un sistema muy complejo formado por muchas cadena polipeptídicas que puede funcionar de manera reversible. Al hidrolizar ATP se sacan protones en contra de gradiente. La ATP sintasa está regulada estrictamente para que no haga la función inversa, bombear protones hidrolizando ATP cuando la concentración de ATP es alta. En mitocondrias y cloroplastos hay subunidades adicionales. La ATP sintasa de las mitocondrias tiene un componente llamado OSDP (péptido que confiere sensibilidad a la oligomicina). La oligomicina es un antibiótico que inhibe la síntesis de ATP. Para la síntesis de ATP por fosforilación oxidativa se han aprovechado mecanismos que la célula ya tenía que bombean protones hidrolizando ATP. Funcionando al revés sintetiza ATP.
Estructura de los cofactores
NAD: adenin nicotín dinucleótido. Puede transportar dos electrones a la vez con la nicotinamida y un H+. capta iones hidruro formando NADH. Hay una forma fosforilada, NADP que tiene un P en el C2; no participa en la cadena respiratoria, sólo en reacciones de biosíntesis. Los enzimas con NAD participan en la oxidación de grupos OH formando grupos carbonilo. Siempre unido débilmente al enzima (coenzima).
FAD: flavin adenín dinucleótido. Lleva los e- del anillo de isolocsatina en el anillo de flavina. Transporta e- de 2 en 2 y 2 átomos de H+ (H2). El mononucleótido con el anillo de isolocsatina puede funcionar como FMN (flavilmononucleótido). FAD y FMN se unen normalmente de forma covalente al enzima (grupos prostéticos). Si el enzima forma doble enlace, suele llevar FAD.
© Javier de Lucas