FARMACOLOGIA MOLECULAR

La farmacología molecular es una rama de la farmacología que se encarga del estudio de la relación que existe entre la estructura química de agentes bioactivos y el mecanismo molecular del efecto farmacodinámico de éstos en las células de un organismo. Esto ha resultado de gran utilidad ya que ha permitido predecir posibles efectos de otros medicamentos con estructuras y funciones similares, teniendo un mejor control sobre el uso de drogas y hacer posible la modificación de las mismas, por ende: mejores resultados clínicos con menores efectos adversos. Este conocimiento ha dado lugar a identificar en diversas células específicas (a las que los fár-macos van dirigidos), sitios de acción a los cuales el fármaco se une creando un complejo fármaco-receptor, desencadenando una serie de modificaciones bioquímicas que ocasionan una modificación de la actividad célula, ya sea aumentándola o disminuyéndola, es decir no origina nuevas funciones.
Interacción fármaco-receptor
Los receptores farmacológicos son aquellas moléculas con las que el principio activo del medicamento interactúa de manera selectiva, para ocasionar una constante y específica modificación en la función biológica de la célula. La modificación del efecto biológico de una célula por un agente bioactivo se lleva a cabo por la formación selectiva, reversible o irreversible, de un complejo molecular entre el fármaco y el receptor celular específico para el mismo. Este receptor generalmente es una macromolécula, ya sea una proteína u otro biopolímero. La correcta y funcional formación del complejo fármaco receptor depende de la estructura molecular de ambos elementos, lo que conlleva a la integración de determinados componentes funcionales o estructurales que definen el farmacóforo, formando un sitio activo. Los componentes estructurales farmacofóricos dan al agente activo su capacidad para activar un determinado receptor induciendo el efecto biológico específico del medicamento, mientras que los componentes estructurales que integran el sitio activo definen las propiedades fisicoquímicas que los elementos farmacofóricos requieren.
Aunque gran parte de la asociación fármaco-receptor genera una respuesta biológica determinada, existen otras asociaciones que no generan respuesta alguna de la célula, ya que la molécula celular no se ve alterada por el principio activo del medicamento de tal forma que pueda afectar la actividad biológica de la célula. Estos sitios se conocen como sitios de pérdida o sitios de fijación inespecíficos. La interacción fármaco-receptor es de naturaleza dinámica, comporta una adaptación mutua del complejo referente a la estructuración molecular y distribución de cargas de ambos elementos moleculares. Se lleva a cabo gracias a la formación de distintos tipo de enlaces. La fuerza de estos enlaces determinará la reversibilidad de la unión fármaco-receptor. Por ejemplo, cuando la formación del complejo fármaco-receptor es covalente, en la mayoría de los casos el efecto farmacológico se ve prolongado.
Naturaleza de los receptores
Los receptores farmacológicos son estructuras macromoleculares que pueden ser encontrados en diversos lugares de la célula de un organismo, como son: en la membrana plasmática, citosol y membranas de organelas. Las proteínas celulares integran la principal clase de macro-moléculas que cumplen la función de receptor con el fármaco, formando el complejo fármaco-receptor. Se pueden clasificar generalmente en cuatro grupos.
1. Canales iónicos: es una proteína transmembranal estructurada por diversas unidades, formando un conducto que permite el paso de diversos iones. Funcionan con base en un gradiente electroquímico y de concentración, trasportado iones específicos como lo son K+, Na+, Ca+. Estos canales se pueden encontrar: abiertos o activos, cerrado o inactivo sin poder ser activado, o cerrado en estado de reposo con la posibilidad de ser activado (imagen 1). Pueden ser receptor-dependientes, siendo activados por un ligando endógeno en un sitio específico del canal que cumple el papel del receptor del ligando, o voltaje-dependientes, es decir, activados previamente por despolarización.
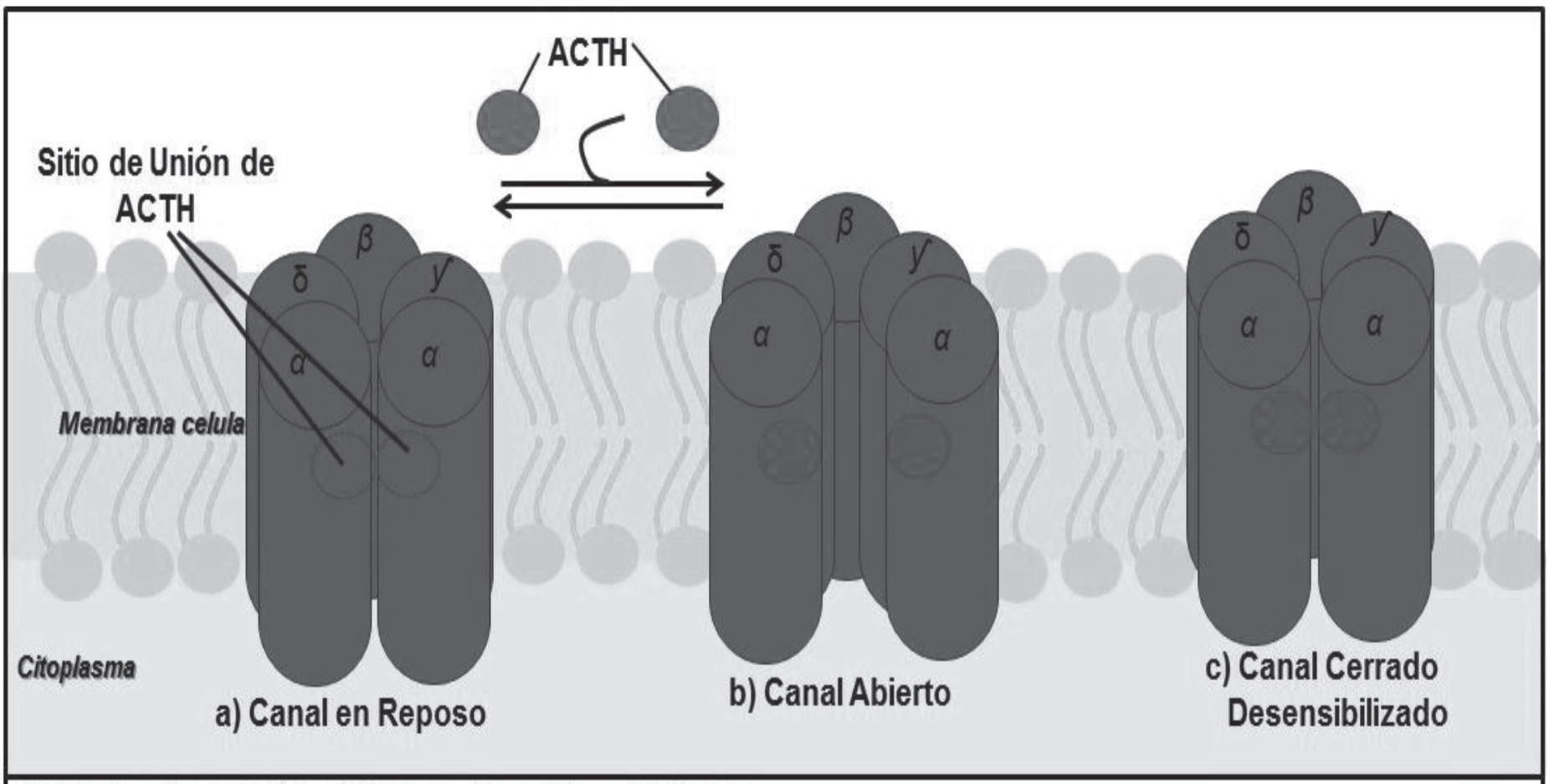
Imagen 1. Estructura de canal iónico. Receptor nicotínico.
2. Enzimas: son la diana farmacológica de diversos medicamentos (imagen 2), los cuales inhiben determinadas reacciones enzimáticas ocasionando una acumulación de sustratos o reducción de algunos metabolitos. Estos efectos pueden ser reversibles y a su vez competitivos o no competitivos (acorde a su entrada en el proceso de reacción enzima-sustrato), o así como efectos no reversibles.
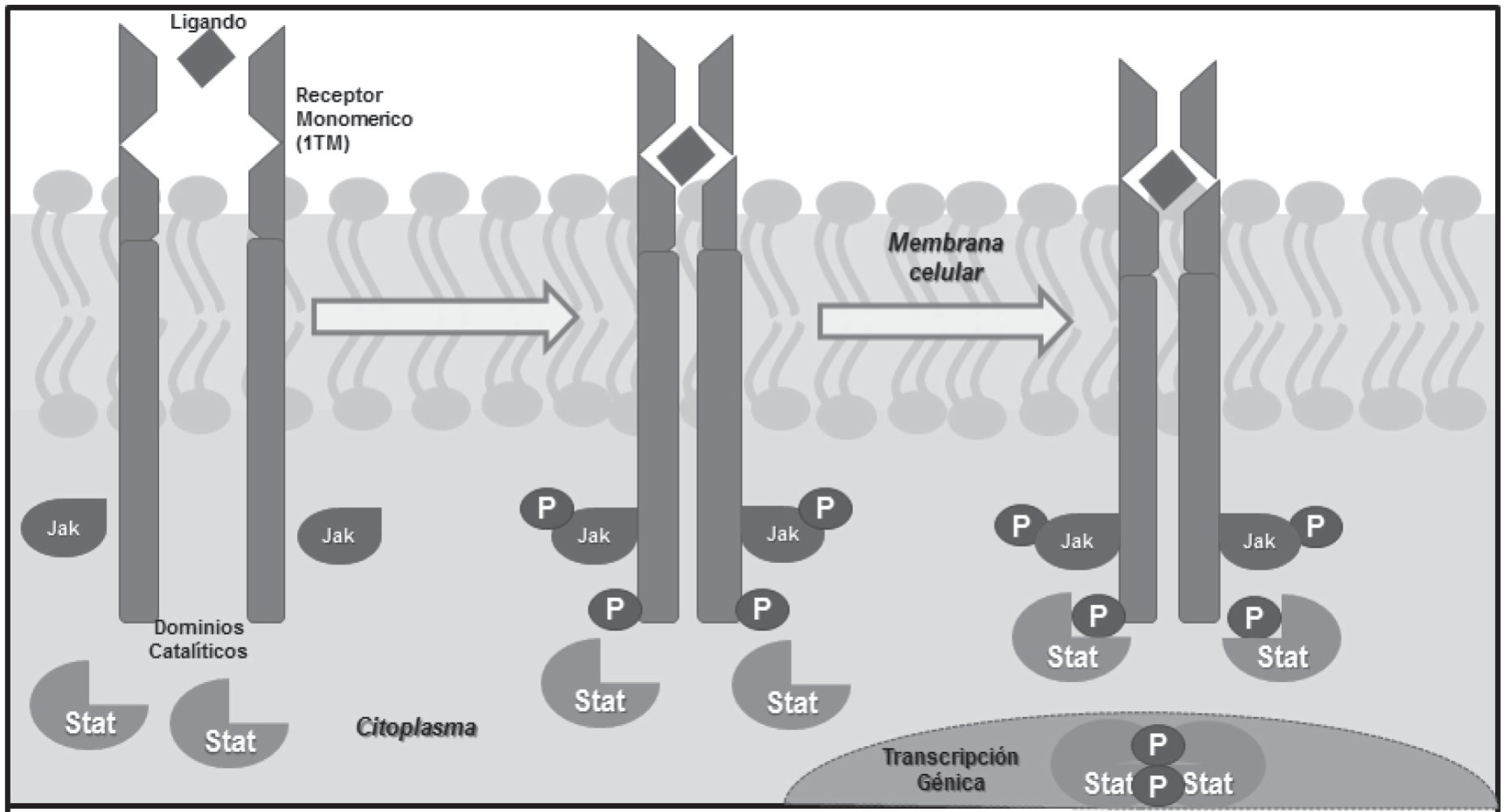
Imagen 2. Estructura de receptor con actividad tirosina cinasa rtk.
3. Trasportadores: permiten el paso de moléculas orgánicas pequeñas así como el movimiento de iones (imagen 3). Los trasportadores solo son capaces de fijar pocas moléculas a la vez. Las proteínas trasportadoras tienen sitios de reconocimiento con los cuales el ligando endógeno se combina. Esta unión causa una modificación estructural del trasportador permitiendo trasportar moléculas a través de este.
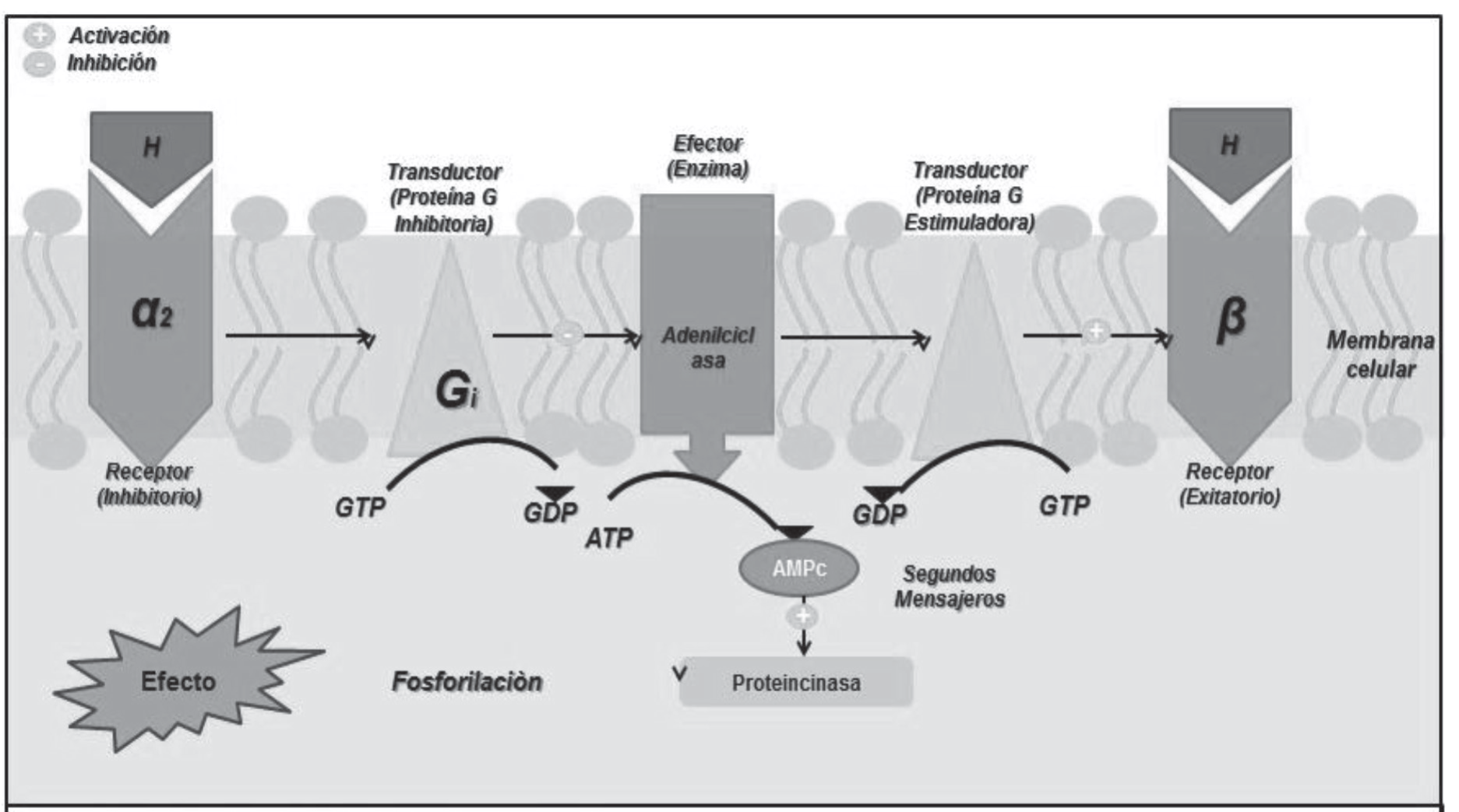
Imagen 3. Receptor de tipo transportador.
4. Receptores fisiológicos: actúan por mecanismos catalíticos, lo cual los hace buenas dianas farmacológicas ya que amplifican señales bioquímicas. Su función es fijar el ligando adecuado y distribuir su señal reguladora al interior de la célula, mediante el sistema receptor-efector o vía de transducción de señales que está integrada por un receptor, transductor y un efector. Se conoce la existencia de dos dominios en el receptor de los cuales uno es efector y el otro de unión para el ligando. La vía de traducción de señales es por donde se propaga la señal reguladora del ligando al interior de la célula. Un claro ejemplo es el de los receptores acoplados a proteínas G, así como la consecuente acadenilciclasa sensible a hormonas (imagen 4).
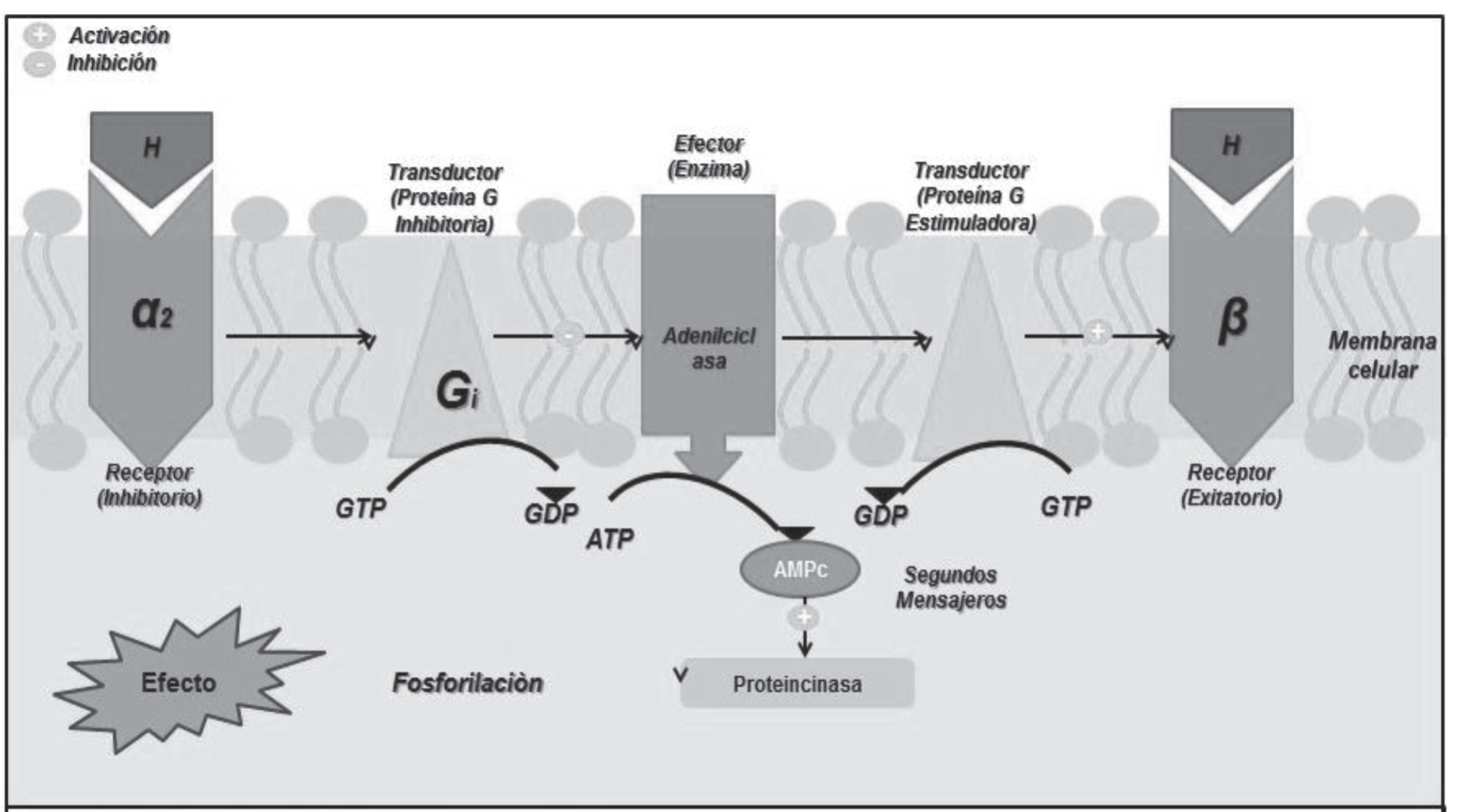
Imagen 4. Receptor transductor. Segundos mensajeros.
Familias de receptores
Dependiendo del mecanismo de transducción y la estructura que posea el receptor se reconocen cuatro tipos diferentes de familias de receptores fisiológicos.
Receptores acoplados a proteína G
Se encuentran en la membrana celular. Regulan distintas moléculas efectoras por medio de proteínas G, un grupo de proteínas con función transductora y con la cualidad de fijar e hidrolizar al guanosintrifosfato. Se le conocen también como “receptores metabotrópicos” o “metabotropos” (imagen 15). Este tipo de receptores son capaces de regular respuestas al interactuar con distintas moléculas de señalización como glicoproteínas, neuropéptidos, hormonas, etcétera.
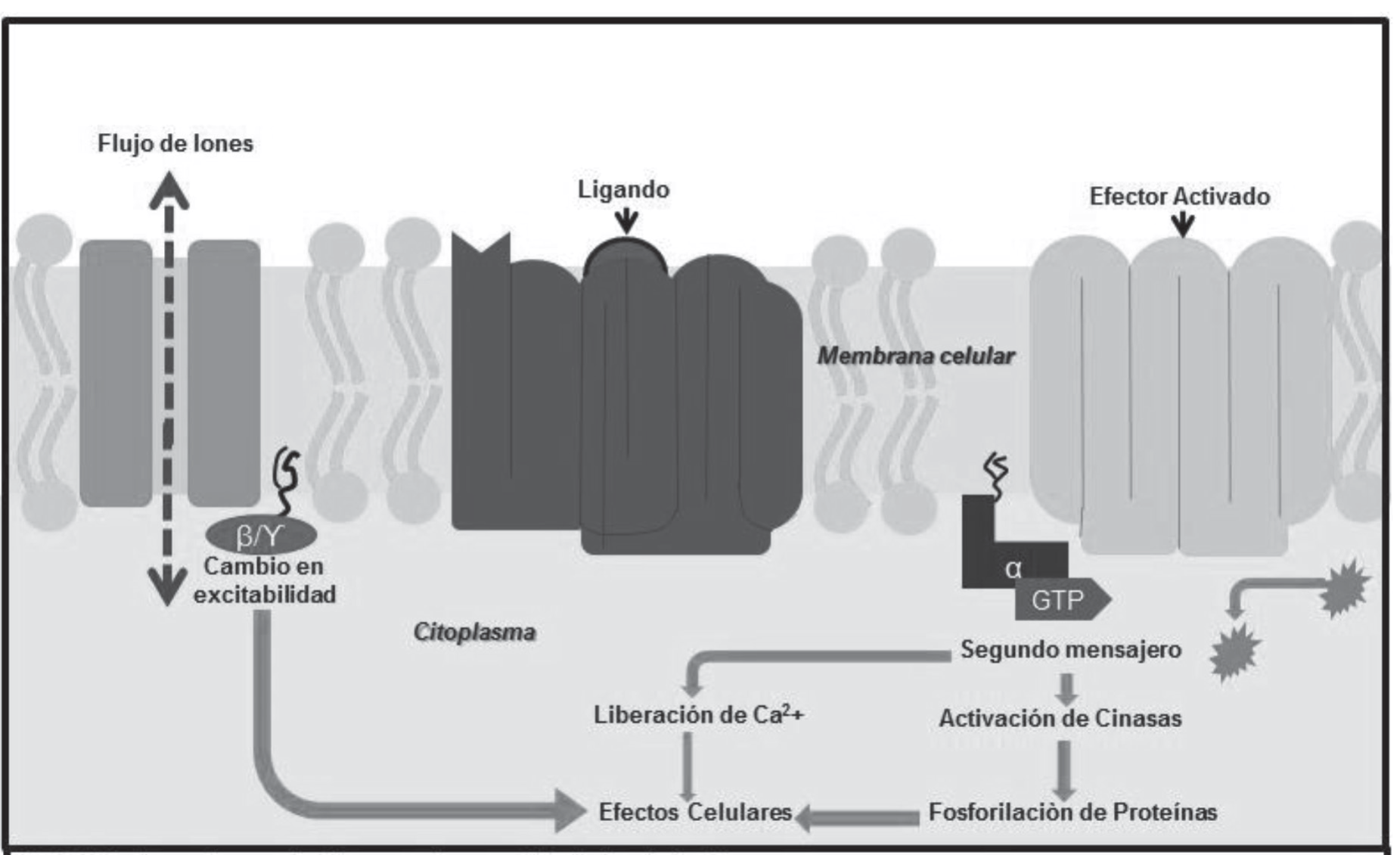
Imagen 5. Estructura de receptores metabotrópicos.
Gran parte de este tipo de receptores poseen una estructura muy parecida, que la integran en una cadena polipeptídica con siete segmentos α-hélice transmembranales unidos por tres asas polipeptídicas intracelulares. El sitio de acoplamiento a la proteína G, formada por un asa larga estructurada por aminoácidos hidrófilos entre las hélices 5 y 6. De igual forma se integran tres asas extracelulares así como una cuarta asa citoplasmática que puede ser formada a la unión de un segmento C-terminal a la cadena de aminoácidos o un segmento N-terminal extracelular (imagen 6). El tamaño de las asas que se encuentran fuera de la célula es muy variado entre los receptores acoplados a proteínas G (rapg), siendo sólo e1 la de tamaño más estable, mientras que las asas e2 y e3 poseen un tamaño diverso.
Este tipo de receptor tiene siete dominios transmembranales (tm), diferentes en su estructura intra o extracelular, que poseen entre 20 y 27 aminoácidos. Al ser activados por un agente bioactivo adecuado, los RAPG son capaces de activar y reconocer más de una proteína G, interactuando solo con un subtipo determinado de los presentados en una célula. Cabe resaltar que para que se lleve a cabo una acción específica sobre una vía de señalización intracelular por la unión a una proteína G, es necesaria una estructura determinada de las asas intracelulares así como de la región C-terminal de los rapg.
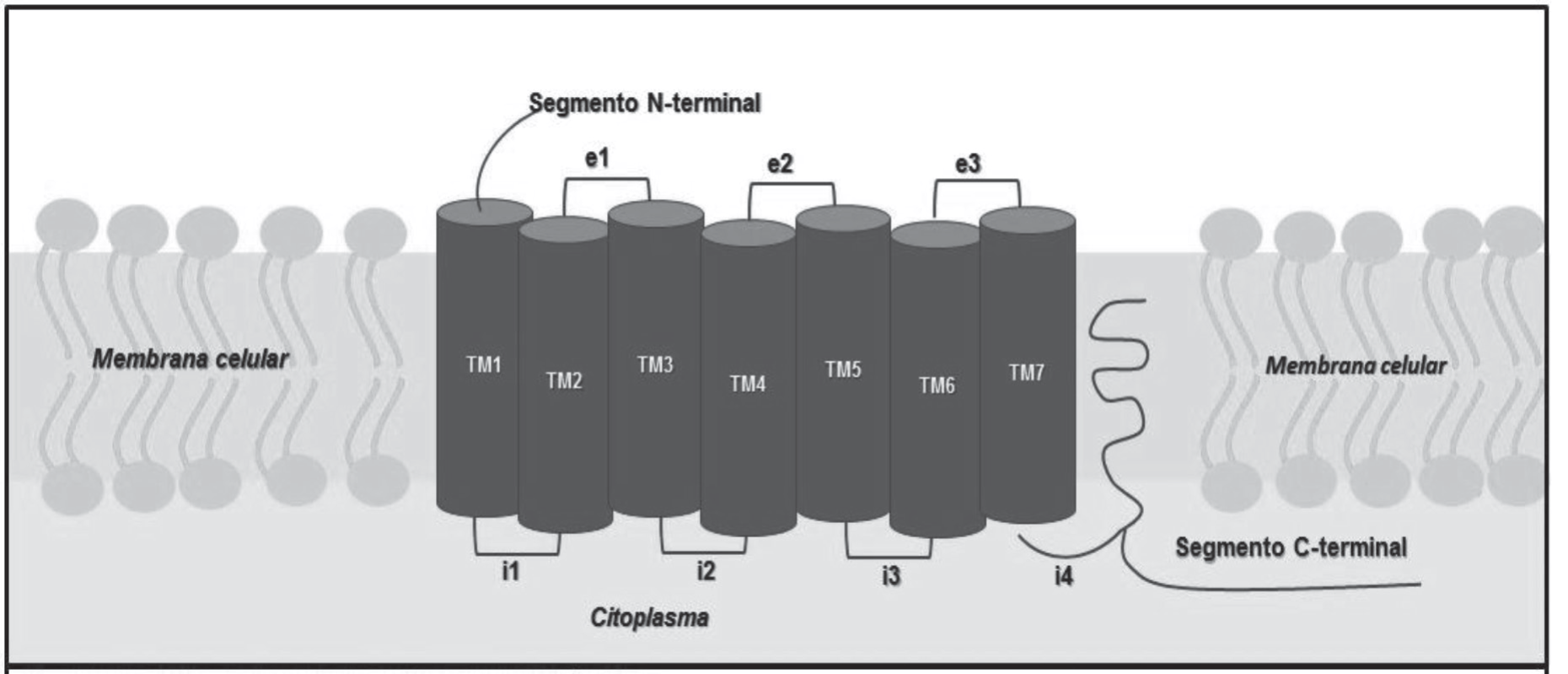
Imagen 6. Estructura de receptor acoplado a proteína G.
El efecto provocado por el acople a proteínas G depende del agente bioactivo, así como del receptor con el que se llevará a cabo la interacción de éstos. Se conoce la existencia de una familia de proteínas G dentro de la cual se encuentran: receptores adrenérgicos α y β, colinérgicos, muscarínicos, purinérgicos, receptor gaba, receptores de opioides, etc. Esta familia de proteínas G al verse estimulada por receptores metabotropos cambia señales de ligandos que regulan la inhibición o activación de proteínas efectoras, pudiendo ser proteínas de trasporte, canales iónicos y enzimas.
El efecto de la proteína G es dependiente del ligando y receptor con el que interactúan. Existe cierta carencia de selectividad de estos receptores, ya que son capaces de activar diversos tipos de proteína G. Debido a la estimulación o inhibición de las proteínas G sobre determinadas enzimas y la similitud y función de sus subunidades α, puede ser clasificada en tres familias:
Proteínas Gq
Activan la fosfolipasa C-β, hidrolizando el enlace éster del fosfati-dilinositol1-2,5 bifosfato (pip2), lo cual da origen a segundos mensajeros: el diacilglicerol (dag) y el inoisitol 1,4,5 trifosfato (IP3), el cual se une a su receptor en el retículo endoplasmico liberando Ca2+ al citoplasma, siendo considerado como un segundo mensajero, ya que está involucrado en la activación de algunas enzimas como la calmodulina. El dag y el Ca2+ en conjunto activan otras cinasas como la protein cinasa dependiente de Ca2+ (pkc), la cual fosforila a otros canales, receptores y enzimas.
Proteínas Gs
Considerada como estimuladora gracias a su efecto sobre la actividad de la adenilato ciclasa, catalizando la desfosforilización. De atp a amp cíclico el cual se une a la regiones reguladoras de la proteína cinasa A (pka), llamada también como cinasa dependiente de amp cíclico (ampc) lo que libera a las subunidades catalíticas de la pka que fosforilan a determinados sustratos.
Proteínas Gi
Esta clase de proteína posee un efecto inhibidor sobre la adenilato ciclasa y la cascada de ampc derivada de esta agregando una disminución de la entrada de Ca2+. Las subunidades Bi se unen causando la apertura de canales de K+ y la salida del mismo estabilizando la polarización de membrana celular disminuyendo la posibilidad de despolarización.
Receptores que regulan la trascripción de genes
(factores de trascripción)
Estos receptores se pueden encontrar en el citosol o núcleo celular, y actúan mediante la regulación de la trascripción de genes. Para que el principio activo del medicamento forme el complejo fármaco-receptor y se desencadene la respuesta biológica esperada, es necesario que el fármaco penetre primeramente la membrana celular e ingrese al interior de la célula. En estos receptores se puede diferenciar dos regiones: una a la que se unirá el ligando y otra región a la que se unirá el receptor con secuencias específicas de adn. Al formarse el complejo fármaco-receptor se lleva a cabo una modificación del receptor, lo que causa que pueda haber una asociación al dna cromosomal, llevándose acabo finalmente una modificación en la síntesis de proteínas de dichos genes.
Un claro ejemplo de este tipo de receptores son los ligados a cinasas (imagen 7), siendo los principales aquellos con actividad tirosin cinasa (rtk) (imagen 2) que agrupan receptores tipo Toll así como receptores de diversos factores de crecimiento, receptor serina/treonina cinasas, receptores de citosinas, y receptores ligados a guanilato ciclasa. Estos receptores son autoforforilados al ser activados.
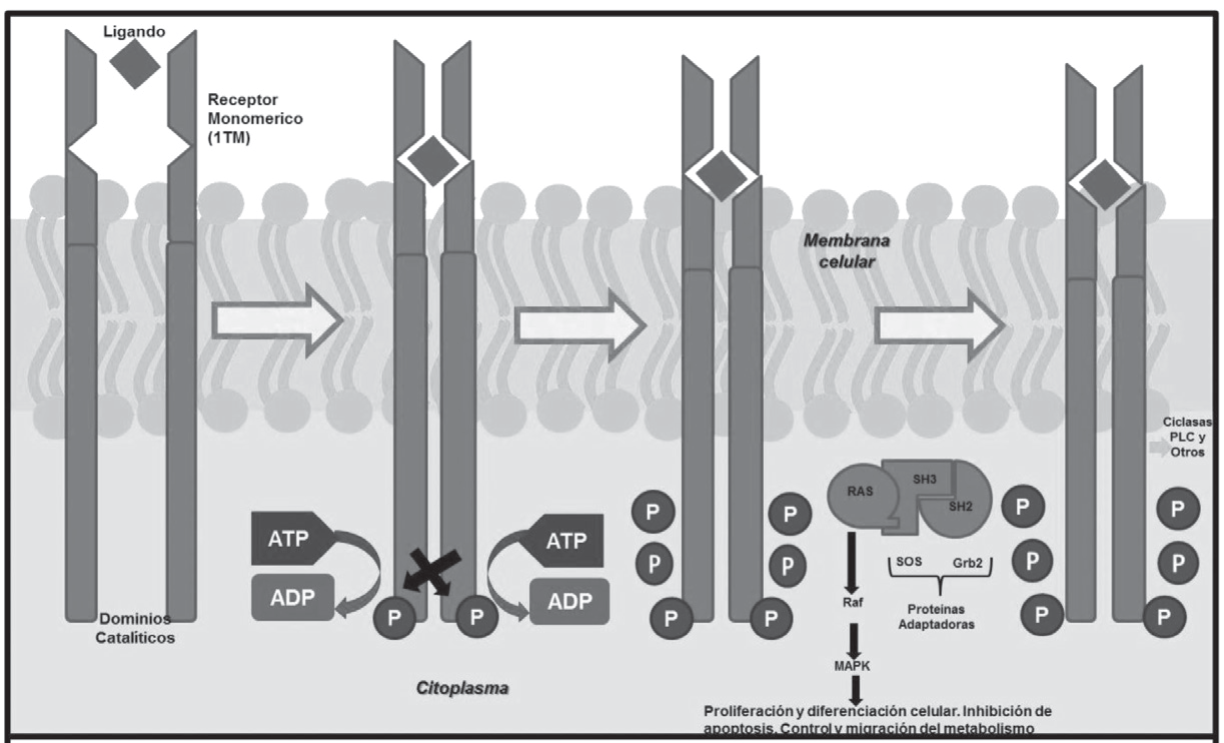
Imagen 7. Estructura de receptor con actividad cinasa.
Receptores acoplados a canales iónicos (inotrópicos)
Se encuentran formados por un canal iónico y se ubican en la membrana celular (imagen 8). Los mediadores fisiológicos que desencadenan efectos biológicos en cuestión de milisegundos actúan mediante este tipo de receptores. Al unirse el ligando al receptor se ocasiona cambios en el potencial transmembranal, generando una despolarización o repolarización, permitiendo la apertura o cierre de este canal. A este tipo de receptores se inte- gran los siguientes:
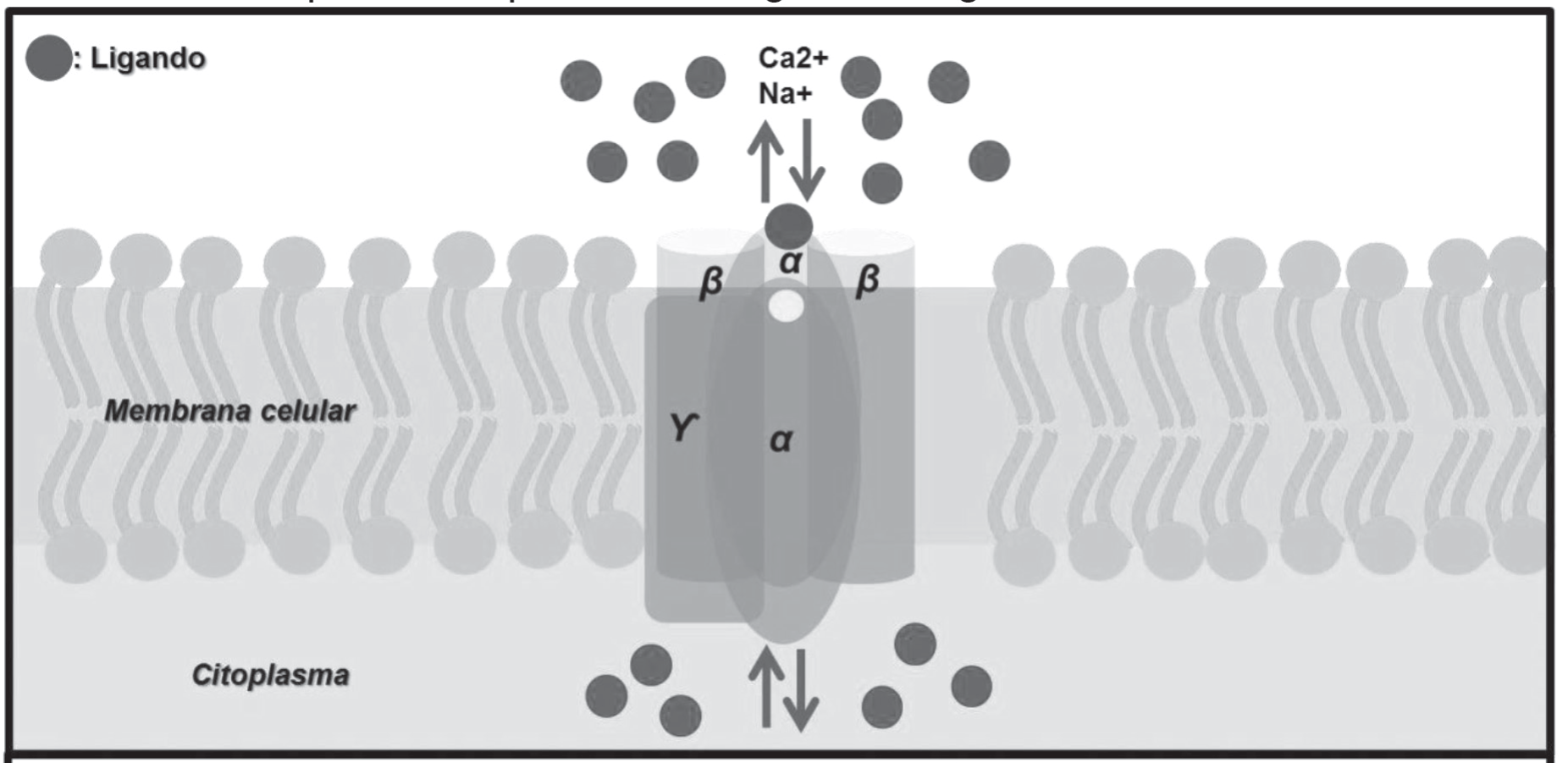
Imagen.8. Estructura de receptor acoplado a canales iónicos
El receptor 5-HT3 es sensible a la 5-hidroxitriptamina. Su es-timulación permite la activación de canales y da origen a una despolarización. Tiene una especificidad para los iones Na+ y K+. El receptor gabaa y glicina, regulan el potencial eléctrico de la célula a la activación de canales excitadores disminuyendo la despolarización espontanea. Los receptores gaba abren el canal iónico permitiendo, a su vez, el paso de iones de Cl-, ocasionando un efecto inhibidor del potencial eléctrico celular. El receptor glicina está estructurado por cinco subunidades que forman en el centro de éstas un canal integrado por tres subunidades: glicoproteínas α, β y la gefirina.
Existen cuatro tipos diferentes de receptores glutamato/as-partato de los cuales tres integran canales iónicos al complejo molecular del receptor, a saber: n-metil-d-aspartato (nmda), ácido α-amino-3hidroxi-5metil-a-isoxiazolpropionico (ampa) y kainato. El ampa no diferencia entre Na+ y K+, pero si diferencia el Ca++. Los receptores de kainato frecuentemente se asocian con receptores ampa. El receptor nmda regula los potenciales postsináptica excitadores lentos. El canal de este receptor da paso a Na+, K+ y Ca++.
Receptor con actividad enzimática
Se localiza en la membrana celular y está formado por dos elementos: una región a la que el ligando se fija y otro dominio efector que posee la actividad enzimática propia. La unión del ligado al dominio de fijación extracelular causa los cambios necesarios para que el dominio intracelular desencadene su efecto específico. A esta familia pertenecen los receptores con proteínas quinasas que actúan fosforilando proteínas efectoras, ocasionando una modificación de sus propiedades o influyendo en su interacción con otras proteínas. Los ligandos de estos receptores son molécu- las peptídicas que forman parte de los factores de crecimiento. De igual forma, en esta familia se integran los receptores con actividad guanilato ciclasa, cuyos ligandos son una serie de hormonas peptídicas como el péptido atrial natriurético.
La respuesta de los receptores con actividad enzimática puede ser tardía o inmediata, y de duración prolongada. Como mencioné anteriormente, los receptores farmacológicos pueden encontrase en la membrana plasmática (canales iónicos, acoplados a proteína G, etc.) pero de igual forma existen receptores intracelulares los cuales encontramos en el núcleo celular o el citoplasma de la célula, es decir receptores intracelulares.
Receptores intracelulares
Este grupo está integrado por proteínas solubles e intracelulares codificadas por una familia de genes, las cuales fungen como receptores lipofílicos, así como de receptores de ácidos grasos y prostaglandinas. Este tipo de receptores está formado por cinco dominios proteicos, A, B, C, D, E (imagen 9). En el caso de algunos receptores como los de ácido retinoico (rar) y los estrogénicos (er), poseen un dominio F a cuya función —a pesar de no ser clara— se le atribuyen acciones inhibitorias.
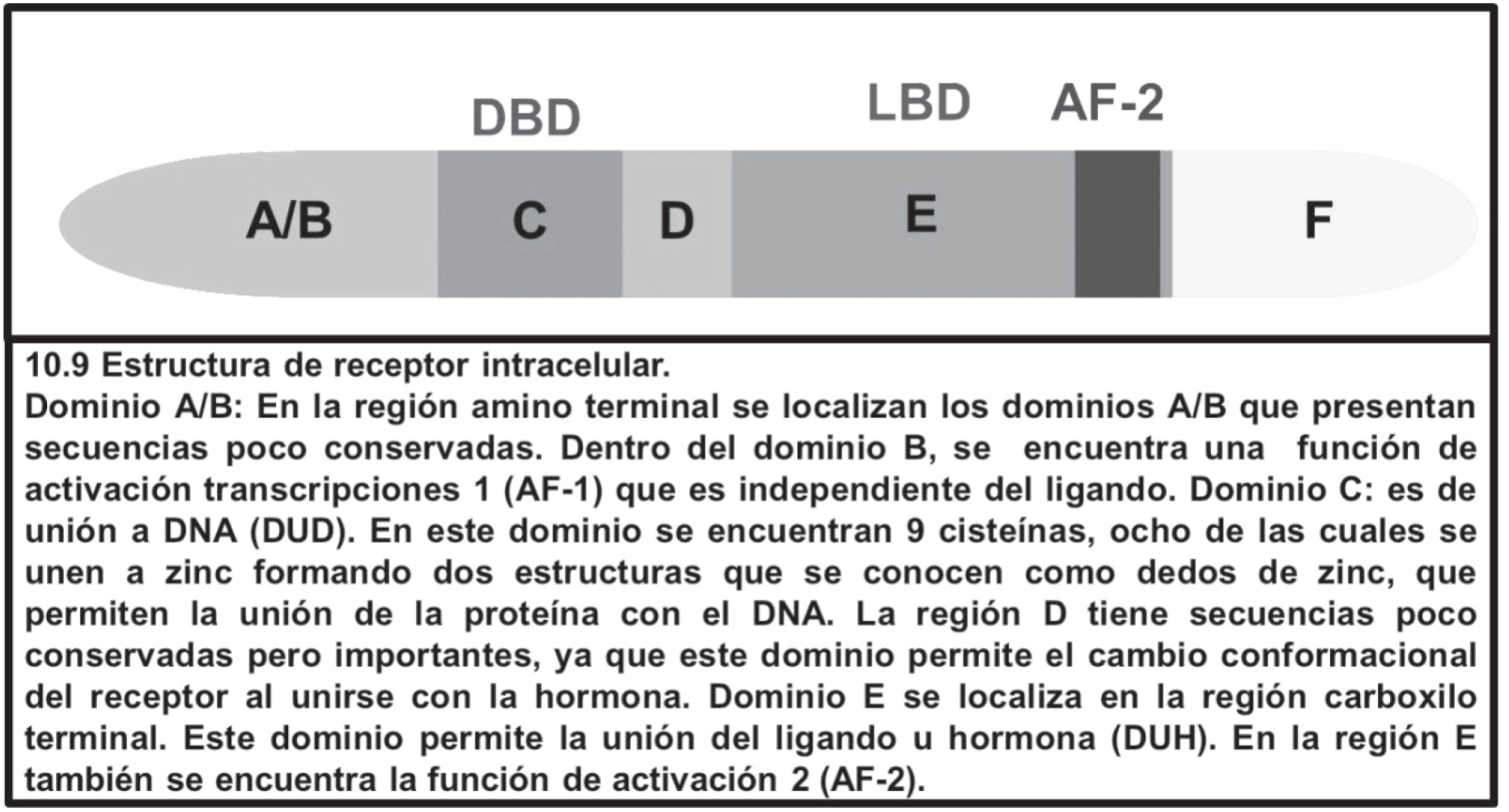
Imagen. 9. Estructura de receptor intracelular.
Dentro de esta familia se encuentran distintos tipos de receptores:
• Receptores intracelulares para sustancias liposolubles. Diversos ligandos son liposolubles (como los esteroides y las hormonas tiroideas) y pasan a través de la membrana sin necesidad de un canal, los cuales estimulan a la trascripción de genes al interactuar con secuencias específicas de adn.
• Receptores huérfanos. Se encuentran en el núcleo celular y poseen participación en distintas funciones como la regulación del crecimiento, además de ser la diana para diversos medicamentos.
• Receptores de hormonas esteroideas, en los que se incluyen los receptores de mineralocorticoides (mr), de estrógenos (er, alfa o beta), de andrógenos (ar), de progesterona (pr) y de glucocorticoides (gr).
• Receptores que forman heterómeros con el receptor de ácido 9-Cis-retinoico (rxr), como lo son receptores de hormonas tiroideas, receptor de ácido retinoico (rar), etcétera.
Los receptores intracelulares en su estado de reposo permanecen unidos a proteínas de choque térmico, que al unirse a un ligando específico ocasiona una modificación estructural. Los receptores ubicados en el núcleo celular poseen la cualidad de formar homodímeros o heterodímeros con otros receptores. El mecanismo de acción de receptores nucleares es la interacción del sitio activo con un ligando que promoverá la trascripción al asociarse a elementos de repuesta hormonal (erh) específicos en genes diana. A la supresión activa de genes diana por asociación a un erh en ausencia de un ligando se le conoce como represión activa, y se lleva a cabo gracias a algunos receptores nucleares los cuales forman heterodímeros con receptor retinoide X (rxr) como el de hormonas tiroideas y ácido retinóico. La transrepresión es la inhibición de actividades de otros factores de transcripción de manera ligando-dependiente, sin unión directa adn, y es causada por varios receptores nucleares.
© 2026 JAVIER DE LUCAS