ONDA Y CORPUSCULO

La existencia de partículas de luz exige
que lleven asociada una onda y una energía que, si esta es cinética, debe tener
la forma
E. Cinética (Fotón de luz) = m fotón · c2
Puesto que esta energía es equivalente
a E = h n, la longitud de onda l está
relacionada con la masa del fotón de luz. Este hecho sugirió a Louis deBroglie la idea que las partículas muy pequeñas (como los
electrones) también pueden tener propiedades ondulatorias de manera que si este
e- se mueve a la velocidad ve ,
entonces lleva asociada una longitud de onda, lo que nos introduce a las
características ondulatorias del electrón. Este análisis, algo más detallado,
lo hizo deBroglie en su Tesis Doctoral en 1925 y dos
años después Davisson y Germer
(Laboratorios de Bell Telephone) demostraron la
difracción de electrones al enviar un haz de e- a través de un cristal,
comprobando que se producen fenómenos similares a rayos X (que son fotones de
radiación electromagnética). Este comportamiento sólo es posible para las ondas
y comprueba en forma contundente que los electrones tienen propiedades
ondulatorias. Por lo demás, el comportamiento ondulatorio de los electrones es
una proeza muy bien aprovechada en la construcción del Microscopio Electrónico,
que permite amplificar los objetos que son demasiado pequeños para que puedan
ser vistos como en Microscopia común.
Las ideas desarrolladas hasta ahora nos
llevan a plantear la existencia de una nueva Mecánica para  las
partículas pequeñas, que tomen en cuenta las siguientes tres características
fundamentales:
las
partículas pequeñas, que tomen en cuenta las siguientes tres características
fundamentales:
Las propiedades ondulatorias de las
partículas propuestas por Einstein, La cuantización
de la energía y de las órbitas propuestas por Bohr y La Incertidumbre de Heisenberg (solo podemos determinar, en forma aproximada,
la posición y velocidad de las partículas).
Esta nueva mecánica es la Mecánica
Ondulatoria, o bien, Mecánica Cuántica.
Erwin Schrodinger, un
físico austríaco, decidió atacar el problema de la estructura electrónica de
átomos poniendo especial énfasis en las propiedades ondulatorias del electrón.
Postuló que el e- atrapado por la fuerza atractiva de
un núcleo debe ser similar a una onda estacionaria en la órbita, de la misma
manera que lo es una onda de un instrumento de cuerda (guitarra, violín, etc). Allí, cada cuerda está fija en ambos extremos y vibra
para producir el tono musical. Las ondas producidas, se describen como
estacionarias, ya que su amplitud es  nula en los extremos
de la cuerda, como lo muestra la Figura. Los puntos allí indican los nodos o
puntos de cero de la onda de la vibración de la cuerda.
nula en los extremos
de la cuerda, como lo muestra la Figura. Los puntos allí indican los nodos o
puntos de cero de la onda de la vibración de la cuerda.
Además, allí se observa que hay
limitaciones respecto a las longitudes de la onda permitida, que pase por cero
en los extremos. Puesto que cada extremo es fijo, solo se permite "un
número entero de media longitud de onda".
Igual situación ocurre con el electrón
en el átomo H. Sólo algunas órbitas circulares tienen circunferencias en las
cuales un número entero de ondas pueden entrar. Todas las otras órbitas deben
producir interferencias destructivas que harían que, eventualmente, la onda
desapareciera con la consiguiente pérdida del electrón. Esto se consideró una
explicación aceptable para la cuantización de los
niveles de energía y de las órbitas en el átomo H propuesta por Bohr, tanto
desde el punto de vista físico como desde su formulación matemática, de acuerdo
con Schrodinger.
La ecuación de Schrodinger
para la energía que tienen los electrones, puede escribirse como
Hoperador y =
E y
El tratamiento es muy complicado
matemáticamente para presentarlo aquí. Solo interesa en estos momentos señalar
que y se conoce como la función de onda del electrón y H (operador hamiltoniano) se refiere a un conjunto de instrucciones
matemáticas para que, cuando se aplica a la función de onda y que
describe el electrón, reproduce exactamente el valor de su energía en el átomo.
Sucede que existen varias energías E que reproducen la igualdad de esa
ecuación, formando así un conjunto posibles de valores de Energías que forman
las órbitas ya conocidas, pero que esta vez están descritas por la función
de onda y para el movimiento del e- . Una función de onda y da
origen a un orbital.
Para comprender su significado, tomemos la función de onda de la órbita más
estable del átomo de Hidrógeno: esta función se conoce como "1s".
Nuestro interés será comprender el significado de la palabra orbital. Algo nos
queda claro de todo lo dicho; no es un órbital de
Bohr, por cuanto la teoría de Bohr define el "radio" de manera
precisa y con la forma circular alrededor del núcleo, que no corresponde
exactamente con la realidad. Entonces, ¿cómo se mueve el electrón y por dónde,
según el principio de incertidimbre de Heisenberg? La respuesta es muy simple: no lo sabemos.
Solo sabemos que al conocer la energía
del orbital, que contiene un término de velocidad en la energía cinética,
entonces la posición simplemente no la tenemos. Así, no es apropiado expresar
que el electrón se mueve alrededor del núcleo en una órbita definida, como lo
planteó Bohr. Solo podemos tener una información sobre el "posible"
lugar por donde circula, esto es, la probabilidad de que se encuentre en algún
lugar descrito por su onda o función de onda.
ORBITAL y Y PROBABILIDAD |y|2
Dadas las limitaciones existentes para
ubicar el electrón según el principio de incertidumbre y puesto que las
probabilidades son siempre positivas (valores entre cero hasta uno), aunque los
orbitales y pueden adquirir valores positivos o negativos, resulta
entonces que solo el valor |y(x, y, z)|2 , el
valor absoluto del cuadrado de la función y, posee un sentido
probabilístico para un electrón en un punto dado del espacio (x,y,z). Este valor debe ser siempre positivo comenzando
desde cero. Por ejemplo, supongamos que tenemos dos posiciones en el espacio
por donde puede circular un electrón, uno definido por las coordenadas (x1,
y1, z1) y el otro por (x2, y2 ,z2).
Así, la probabilidad relativa de encontrar el electrón en las posiciones 1 y 2
estaría dada por el cociente N1/N2 ,
la razón de probabilidad de encontrar el electrón en las posiciones 1 y 2. Si
suponemos que el valor para el cociente es 100, el electrón es 100 veces más
probable de encontrarse en la posición 1 que en la posición 2. Sin embargo,
esto no nos dice "cuándo" el electrón estará allí o "cómo"
y "por dónde" llegará. Francamente, no lo sabremos nunca pero algo sí
está claro: esta "vaguedad" está de acuerdo con el Principio de
Incertidumbre de Heisenberg.
El cuadrado de la función de onda |y (x,
y, z)|2 se representa más conveniente como una distribución de
probabilidades, en las que la intensidad del color indica la probabilidad que
el electrón, dentro del átomo, ocupe los diferentes sitios en el espacio. En la
Figura se muestra esta distribución de puntos en un átomo y, claramente, no es
una órbita de Bohr sino más bien una densidad de puntos por los que,
probablemente, el e- pasa. Mientras más veces el electrón visita un determinado
punto, más intensidad de color aparece en esa zona. Lo difícil es fijar el
valor del tamaño de este orbital para decir que más allá de un valor dado de
distancia respecto del núcleo, no hay más puntos de probabilidad. Una
aproximación es declarar que por definición, en el átomo H el tamaño del
orbital 1s lo da el radio de la esfera que incluye el 90 % de la probabilidad
total para el electrón.


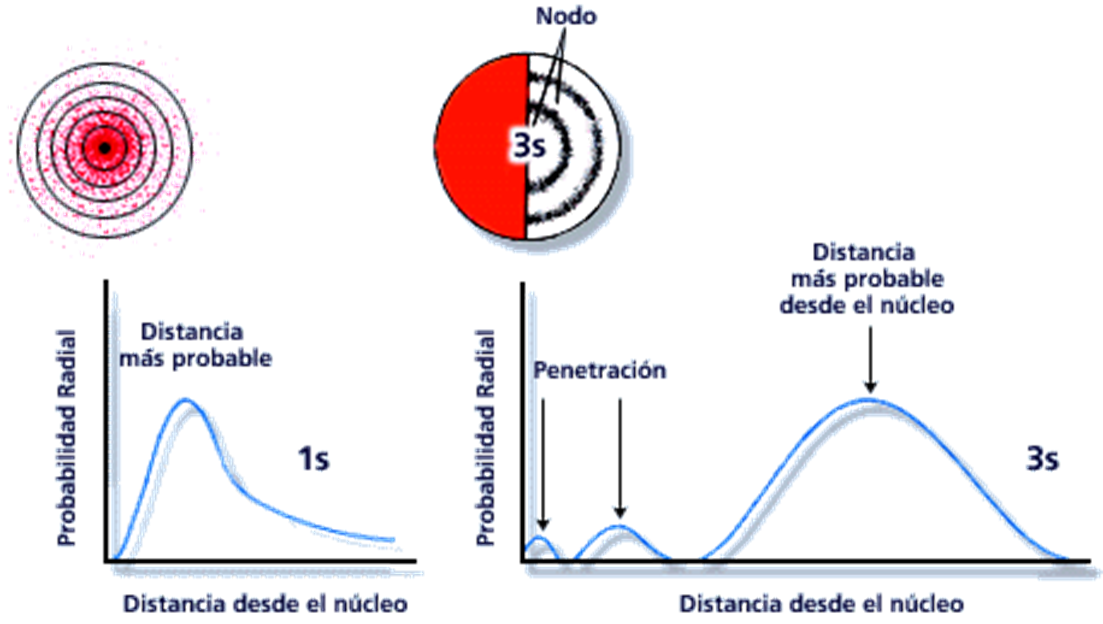
Otra manera de representar la
distribución de probabilidad electrónica para el orbital 1s es calcular los
puntos a lo largo de una línea radial hacia afuera, el resultado que se muestra
en la Figura, en la que se observa que la densidad de puntos disminuye en forma
asintótica cuando el radio aumenta. Esto significa que la probabilidad de
encontrar el e- cerca del núcleo es comparativamente más alta que lejos del
núcleo. Sin embargo, ¿qué vale esta probabilidad para un valor cualquiera del
radio 'r"? La respuesta se puede dar fácilmente si se completa la figura
esférica alrededor del núcleo como lo muestra la siguiente figura. Allí se ve
que cada casquete para el orbital 1s (en forma de rueda) contiene puntos y
estos son mayor cantidad cerca del núcleo. Sin embargo el volumen de un sector
cerca del núcleo es pequeño por lo que acepta pocos puntos. A medida que el
radio aumenta se ve que también aumenta el volumen del casquete, pero cada vez
contiene menor cantidad de puntos de probabilidad. Así, el máximo de la curva
se debe a estos dos efectos contrapuestos y el gráfico de este tipo se conoce
como la distribución de probabilidad radial.
Como ejemplo, en el átomo H con el electrón
en el orbital mas interno 1s , el
máximo de la probabilidad radial aparece a la distancia rmáximo=
0,0529 nm = 0,529 Å, que es el valor logrado por Bohr
para su órbita de n=1. Así, vemos que este Modelo Mecánico-ondulatorio del
electrón sólo habla de valores medios, más probables, pero nunca de valores
exactos.
PROBABILIDAD DE UBICAR UN
ELECTRÓN DENTRO DEL ÁTOMO
Observe cuidadosamente que el electrón no puede entrar al núcleo por lo que la
probabilidad de estar allí es NULA
|
Números Cuánticos de los primeros cuatro niveles de Orbitales en el
átomo H |
|||||
|
n |
l |
Designación |
ml |
N° de orbitales |
|
|
1 |
0 |
1s |
0 |
1 |
|
|
2 |
0 |
2s |
0 |
1 |
|
|
3 |
0 |
3s |
0 |
1 |
|
|
4 |
0 |
4s |
0 |
1 |
|
© 2021 Javier de Lucas