LA RESISTENCIA

¿Cómo las bacterias se hacen resistentes a los antibióticos ?
El bacteriólogo danés Hans Christian Joachim Gram acudió en 1883 a un curso de bacteriología impartido por el Dr. Carl Salomonsen. Un poco más tarde Salomonsen escribió una carta de recomendación al Dr. Carl Friedländer del Servicio de Patología del hospital general de Berlín para que acogiera al joven discípulo Gram en su laboratorio. Gram se trasladó desde Copenhague a Berlín y muy poco tiempo después descubrió una tinción que permitía diferenciar perfectamente bacterias en medio de tejidos de muestras histológicas. A partir de entonces esta tinción ha sido muy importante para diferenciar a las dos principales clases de bacterias: Gram positivas y Gram negativas. Las diferencias en composición y estructura de la pared celular de ambos grupos determinan el tipo de reacción con esta técnica.
Tras la tinción, las bacterias Gram positivas quedan teñidas de morado o púrpura y las Gram negativas de rojo o rosa. La mayoría de los antibióticos actúan sobre una u otra familia y solo unos pocos actúan sobre las dos. Si un paciente está infectado por una bacteria Gram positiva, no se le pueden dar antibióticos que solo afecten a las Gram negativas y viceversa. Cuando no se puede cultivar la bacteria que está causando la infección, se recurre a un tratamiento empírico con antibióticos que actúan contra algunas bacterias de ambas familias, pero esto promueve que, si hay resistencias, tanto las bacterias Gram positivas como las Gram negativas que no se vean afectadas por esos antibióticos de amplio espectro podrían ser seleccionadas por ellos.
Los antibióticos son moléculas —conjuntos de átomos ordenados de una manera especial— que para realizar su función tienen que unirse a otras moléculas presentes en una bacteria para destruirlas, bloquearlas o inactivarlas —sus dianas—. Cada antibiótico distinto tiene una configuración especial, de forma que tiende a pegarse a las dianas que encajan bien con su estructura química.
Imaginemos un edificio de 350 plantas con una puerta por planta. Ese gran edificio es una bacteria y las cerraduras de esas 350 puertas son moléculas diana. Cada cerradura —cada diana de esa bacteria— lógicamente tiene un hueco distinto, para una llave distinta. Las llaves serían antibióticos. Si un antibiótico —una llave— abre una cerradura —su diana—entonces esa puerta abierta haría que la bacteria muriera. Por esa puerta se escaparía el contenido del edificio —el citoplasma de la bacteria— o se perturbaría su estructura interior y el edificio se colapsaría.
Edificio = bacteria
Cerradura = diana para los antibióticos
Llave = antibiótico
Llave + cerradura = puerta abierta, la bacteria muere.
Pues bien, hemos encontrado en la naturaleza más de 100 antibióticos y hemos creado otros tantos a partir de la modificación de esos naturales. Pero muchos están repetidos. Es como si distintos antibióticos —las llaves— solo abrieran una única puerta, por lo que de las 350 cerraduras que hay en una bacteria solo hemos encontrado llaves para abrir unas 20 y matarla. Por si fuera poco, las bacterias han encontrado varias maneras de hacer que esas llaves no abran las puertas para las que han sido creadas. Resisten a esos antibióticos. Así es como actúan estos fármacos, deben unirse a una diana que hay en la bacteria. Cuando un paciente recibe una inyección de antibióticos o los toma en una pastilla, en su cuerpo entran innumerables moléculas del antibiótico que tendrán que buscar y destruir también a miles de millones de bacterias que pueden tener cada una hasta centenares de posibles dianas para ese antibiótico.
Hay tres condiciones básicas que tienen que cumplirse para que un antibiótico mate —antibióticos bactericidas— o inhiba —antibióticos bacteriostáticos— a una bacteria.
Cubiertas de las bacterias gramnegativas
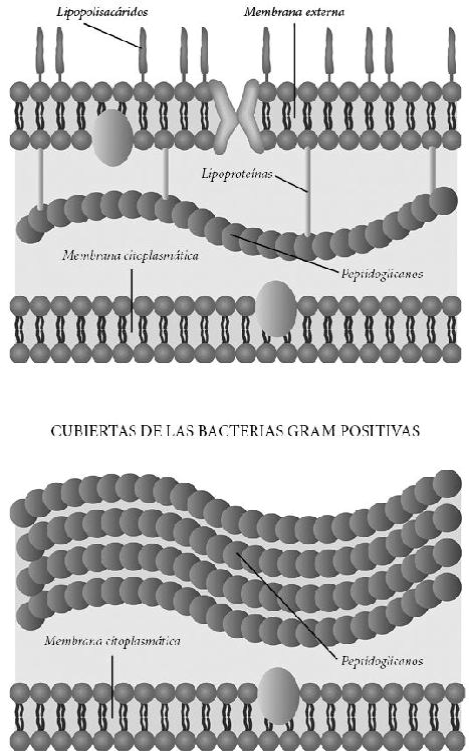
La primera es que su diana debe estar presente en la bacteria. De poco vale que utilicemos un antibiótico que mata a algunas especies de bacterias Gram negativas si la bacteria que está causando la infección es Gram positiva. Los médicos deben saber qué bacteria es para aplicar el antibiótico correcto, aunque a veces, si no tienen ese dato, aplican un antibiótico de amplio espectro para intentar abarcar el mayor número de especies posibles que podrían estar causando esa infección, y así tener más posibilidades de éxito. El tiempo que transcurre entre que se detecta una infección, se toma una muestra del paciente y se identifica la bacteria y se averigua a qué antibióticos es sensible o resistente, es crucial. Cuanto más retrasemos el tratamiento antibiótico más posibilidades hay que la bacteria llegue a más sitios en el paciente y de que la infección sea más difícil de controlar.
La segunda es que el antibiótico debe llegar a su diana en la bacteria, en suficiente cantidad. Recordemos que una infección puede estar localizada en un órgano concreto y que puede estar causada por miles o millones de bacterias, que a su vez tienen muchas dianas para ese antibiótico. Si por ejemplo hay una infección en el cerebro, el antibiótico tiene que llegar a la cabeza del paciente a través de su sangre, en cantidad suficiente para bloquear todas las dianas en todas las bacterias que se encuentran en ese lugar. Las moléculas de antibiótico no llegan desde la vía intravenosa que tiene el paciente en el brazo hasta la cabeza —donde están las bacterias— en 1 minuto. Necesitan más tiempo y tienen que llegar de forma continuada; es decir, su concentración en sangre debe mantenerse el tiempo suficiente para que todas las bacterias mueran. Puede que unas horas o un par de días no son suficientes.
La tercera, es que el antibiótico no debe ser modificado o inactivado desde que entra en el cuerpo del paciente a través del estómago o de una vía intravenosa, hasta que se encuentra con su diana en las bacterias. Es decir, debe resistir intacto al viaje por el cuerpo del paciente hasta donde están las bacterias.
Los antibióticos pueden actuar de varias maneras sobre sus dianas en las bacterias; bien interfiriendo en la construcción o el mantenimiento de los componentes de las envolturas bacterianas (la pared celular y la membrana) o entrado en la propia bacteria para ejercer su función sobre alguna de sus dianas intracelulares. Por ejemplo, sobre la pared celular de las bacterias actúan los antibióticos betalactámicos, como las penicilinas; y sobre sus membranas, los antibióticos de la familia de las polimixinas. Otros antibióticos atraviesan estas envolturas a través de proteínas que forman poros en esas membranas. Estos poros sirven para que la bacteria tome los nutrientes que necesita del medio en el que se encuentra, sea un suelo, el agua de un río o nuestra sangre —son como ojos de buey en un barco—; algunos antibióticos utilizan estos poros para pasar al interior de la bacteria y dirigirse hacia la «diana» sobre la que actúan. Una vez dentro, los antibióticos se unen a distintas moléculas que intervienen en la síntesis de ácidos nucleicos, en la síntesis de proteínas, o que pertenecen a algunas rutas metabólicas, y entonces las inactivan o las destruyen; así la bacteria no puede funcionar correctamente y muere; es el caso de los antibióticos macrólidos, cuyas dianas —los ribosomas— son unos componentes de la maquinaria que tienen las bacterias en su interior para fabricar proteínas.
Pero las mutaciones en los genes que codifican para esas dianas pueden dar al traste con toda la operación antibiótica. Cuando una bacteria se divide, tiene que copiar todo su material genético para darle una copia a su bacteria hija. Madre e hija tienen que dividir su material genético y pasar una copia a sus hijas y así sucesivamente. Es decir, cada bacteria tiene que copiar unos 4 o 5 —o más—millones de pares de bases de su ADN constantemente. Copiar esto con precisión molecular es complicado y entonces surgen los errores o mutaciones. Las mutaciones en los genes de las bacterias se producen al azar y no se crearon específicamente para combatir a los antibióticos. Simplemente ocurren. Si hay una mutación favorable, la calidad de vida de las bacterias en un determinado ambiente mejora, y si es desfavorable, la bacteria muere. En sitios donde hay muchas bacterias dividiéndose constantemente hay más probabilidad de que ocurran mutaciones; es el caso de nuestros intestinos, que están llenos de una cantidad enorme de bacterias que se dividen a menudo, aunque eso sí, más lentamente de como lo hacen en el laboratorio.
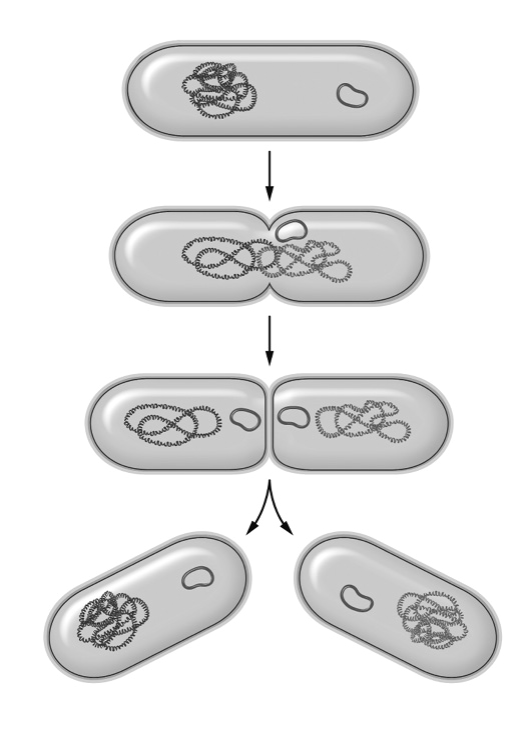
Reproducción bacteriana por fisión binaria
Una mutación en el gen que produce una diana —la proteína a la que se pega un antibiótico— hace que ésta cambie su estructura y ya no sea reconocida por la molécula de antibiótico, así que el antibiótico ya no funciona contra ella. Recordemos que, aunque la probabilidad de que ocurra una mutación en una de las dianas que reconocen los antibióticos en una bacteria no es muy alta —de hecho es — el problema surge porque hay bacterias. Solo en el intestino humano hay 1013 bacterias. Hay tantas bacterias que la probabilidad de que una mutación al azar vaya a ocurrir en la diana de un antibiótico es factible. En cuanto hay una mutación en alguna de esas dianas, la bacteria ya es resistente. Cuando venga el antibiótico, ésta no morirá, y podrá dividirse y extender esa mutación a su prole. Ahora el antibiótico no solo no funcionará contra esas bacterias sino que las seleccionará y favorecerá que esa mutación —ese gen mutado—aumente en número.
Y su número puede aumentar muy rápido. Por muy raro que suene, las bacterias se multiplican por división. Bajo condiciones muy favorables —como en algunas partes del cuerpo humano—algunas bacterias pueden dividirse cada 20 o 30 minutos y formar dos células iguales; una bacteria se divide por la mitad en dos. Esas 2 bacterias se dividen y dan 4 bacterias y esas 4 bacterias se dividen por la mitad y dan 8 bacterias, esas 8 se dividen por la mitad y producen 16 bacterias y así sucesivamente. Cada 20 minutos una división. Si cogemos una calculadora, solo tenemos que aplicar la tabla de multiplicar del 2 unas cuantas veces. Mediante un cálculo rápido podemos comprobar que en poco más de 10 horas habrá más de 1000 millones de bacterias prácticamente idénticas. Si una bacteria tiene una mutación, en pocas horas habrá también 1.000 millones, todas con esa mutación.
Sigamos con los mecanismos de resistencia de las bacterias. Por ejemplo, una vez que un antibiótico atraviesa la membrana bacteriana, algunas bacterias poseen mecanismos que expulsan de nuevo el antibiótico al exterior. A estos mecanismos se los conoce como bombas de eflujo y actúan como un sistema de bombeo de sustancias desde el interior de la bacteria hacia el exterior. Algunas mutaciones son capaces de aumentar la actividad de estos sistemas de bombeo, por lo que expulsan muy rápido al antibiótico hacia afuera y éste no tiene tiempo de ejercer su función en el interior de la célula. En otras ocasiones, las bacterias son capaces de regular o bloquear los poros por los que penetran los antibióticos, y así evitan directamente que pasen al interior. Algunas veces esto se produce por mutaciones que hacen que la permeabilidad se reduzca lo suficiente para mantener a la bacteria a salvo de las drogas.
Los ribosomas son las fábricas de proteínas bacterianas. Algunas mutaciones muy pequeñas —o puntuales— en los genes que codifican la información para construir esos ribosomas hacen que su forma cambie y que el antibiótico —aunque pueda pasar al interior celular— no actúe sobre ellos. Es como si la modificación genética añadiera una pequeña muesca en la cerradura, que hiciera que la llave —el antibiótico— no pudiera entrar correctamente. Además, algunas bacterias tienen enzimas —un tipo de proteínas — que destruyen al antibiótico antes de que entre en ellas. Esto lo llevan a cabo por ejemplo, enzimas hidrolíticas del tipo beta-lactamasas, que destruyen antibióticos beta-lactámicos antes de que tengan tiempo de desbaratar las envolturas de las bacterias.
Aunque la nomenclatura de las beta-lactamasas es demasiado extensa y complicada para tratarla en este artículo, citaré algunas de ellas con nombres curiosos, la mayoría debidos a los lugares donde se encontraron por primera vez. Una beta-lactamasa que hidrolizaba el potente antibiótico imipenem fue descubierta en una cepa de Pseudomonas aeruginosa aislada en un hospital japonés en 1988; se la denominó IMP-1, por destruir al imipenem y estar localizada en un plásmido dentro de la bacteria. Otra es la VIM, (integrón Verona codificante de metalo-beta-lactamasa). Esta enzima fue descubierta 1997, en una cepa también de P. aeruginosa aislada de la herida quirúrgica de un paciente ingresado en la UCI del Hospital Universitario de Verona. En 2001, una niña de 4 años de edad diagnosticada de leucemia fue ingresada en un hospital de Sao Paulo, en Brasil. Durante su estancia se la trató con antibióticos de una neumonía y más tarde se aisló de su orina una cepa de P.aeruginosa resistente a todos los antibióticos menos a la polimixina B. Cinco días después se volvió a aislar la misma cepa de su sangre y al poco tiempo la niña falleció. Esta P. aeruginosa tenía una nueva beta-lactamasa a la que denominaron SPM-1 (Sao Paulo metalo-beta-lactamasa).
Otra enzima parecida fue aislada también de una cepa de P. aeruginosa en un hospital de Dusseldorf en Alemania, en el año 2002 y se denominó GIM (del inglés German IMipenemase). Y otra es la NDM (Nueva Delhi metalo-beta-lactamasa). Esta enzima fue descubierta por primera vez de una cepa de Klebsiella pneumoniae aislada de una paciente de 59 años en Suecia, a principios de 2008, tras haber realizado una estancia en la India, donde pasó por varios hospitales, el último de ellos en Nueva Delhi. Una de las últimas descubierta recientemente es la SIM, aislada en varias cepas de Acinetobacter baumannii en un hospital de Seúl entre los años 2003 y 2004. Se la denominó SIM (del inglés Seoul IMipenemase).
Triclosán y otros productos antibacterianos
Las bacterias pueden eliminarse normalmente con desinfectantes. Al fin y al cabo no dejan de ser organismos muy sencillos, como meras gotas de agua —hasta un 70 % de su composición es agua—en las que flota una sopa de proteínas, lípidos, azúcares y material genético. Todas las bacterias pueden destruirse con el desinfectante adecuado, aplicado durante el tiempo necesario y a una concentración eficaz. Pero se sabe que la exposición a concentraciones sub-óptimas de desinfectantes —de los que podemos tener en nuestra casa— que contienen por ejemplo triclosán, inducen la resistencia a algunos antibióticos. El triclosán es un producto químico con propiedades antibacterianas que se ha incluido en la formulación de distintos productos, desde desinfectantes para el hogar, hasta productos de higiene personal como cremas y jabones para las manos. Como dato: en 2008 se detectó triclosán en el 74,6 % de las muestras de orina —de personas mayores de 6 años— analizadas en un estudio en Estados Unidos.
En 2015, la FDA americana pidió información, explicaciones y estudios a las empresas que añadían triclosán a los jabones que fabricaban, para saber si éstos eran más efectivos que el jabón normal. Al año siguiente fue prohibido junto con otros 18 compuestos químicos. El problema es que ahora sabemos a ciencia cierta que estos desinfectantes y productos químicos que llevábamos utilizando desde hace mucho tiempo ya están en el ambiente; ríos, lagos y suelo están contaminados con ellos en muchas partes del mundo. El ser humano tiene un éxito tremendo cuando intenta llenar de contaminantes su planeta.
Al parecer, los desinfectantes de este tipo influyen sobre el mecanismo de bombas de eflujo que tienen las bacterias para intercambiar compuestos desde el interior al exterior de la célula, creando alteraciones que terminan por fijarse en los genomas bacterianos en forma de resistencias. Lo peor es que la resistencia a estos desinfectantes también puede afectar a los antibióticos; las bacterias se han acostumbrado a utilizar las bombas de eflujo no solo para expulsar a los desinfectantes hacia afuera, sino que han aprendido a hacer lo mismo con algunos antibióticos, creándose una resistencia cruzada entre los desinfectantes y los antibióticos.
Intercambio de cromos
Los genes son las instrucciones para que una persona, bacteria, avestruz, cucaracha, lechuga o cualquier otro ser vivo fabrique proteínas, las pequeñas moléculas que realizan una función o que forman parte de la estructura de las células eucariotas o procariotas. Al igual que usted tiene genes que hacen que sea una persona con el pelo negro o rubio, que sea alta o baja, o que se parezca a sus antepasados, las bacterias pueden tener genes que hagan que tengan proteínas encargadas de resistir a los antibióticos. Desde un punto de vista darwiniano, es decir, de la selección natural, cuando tomamos antibióticos, estos seleccionan a las bacterias que poseen ese gen o genes que les permiten vivir en presencia de ese antibiótico. Si esa bacteria no tiene el gen de resistencia, muere. Pero las bacterias que lo tienen, resisten, y la presión selectiva que ejercen los antibióticos en un determinado contexto aumenta el número de bacterias resistentes a esos antibióticos, ya que estas no solo no mueren, sino que al multiplicarse propagan una prole que también es resistente.
Una bacteria que tiene un gen de resistencia puede pasar sin problemas ese gen de resistencia a sus bacterias hijas; de esta manera no solo aumenta el número de bacterias resistentes, sino que también aumenta el número de genes de resistencia. Y esto es muy importante como veremos más adelante.
En las bacterias, si una tiene un gen de resistencia, se lo puede pasar a otra, y esta se hace también resistente. Para ello solo se necesita que las bacterias sean un poco parecidas entre sí. Si son parecidas, tienen al menos cuatro formas diferentes de intercambiarse genes: capturando e internalizando ADN del ambiente directamente a través de sus membranas, mediante plásmidos, mediante vesículas o mediante virus bacterianos llamados bacteriófagos —o fagos—, a través de un proceso denominado transducción. Es decir, en las bacterias los genes pasan siempre de madres a hijas, pero también por diferentes mecanismos se los pueden pasar entre ellas.
Cazando ADN externo
Las bacterias pueden intercambiar instrucciones para hacer cerraduras nuevas y así engañar a los antibióticos —las llaves—. Estas instrucciones están en los genes y la transferencia de genes es la mayor fuente de diversidad genética de las bacterias, ya que estas se pueden pasar genes o grupos de genes con gran facilidad de unas a otras. Algunas bacterias pueden capturar ADN directamente del ambiente. Bueno, directamente no, no tienen brazos o cazamariposas de ADN. Simplemente todo ocurre dentro de las moléculas. El ADN es una molécula que atraviesa fácilmente las capas que recubren algunos tipos de bacterias; por ejemplo, para transformar a una bacteria en el laboratorio, a veces simplemente hay que depositar una gota de agua que contiene ADN sobre una colonia de esas bacterias, y estas adquieren inmediatamente esos genes. En el laboratorio esto se realiza de manera relativamente sencilla; pero no sabemos si en la naturaleza es igual de fácil o es difícil, simplemente sabemos que puede ocurrir.
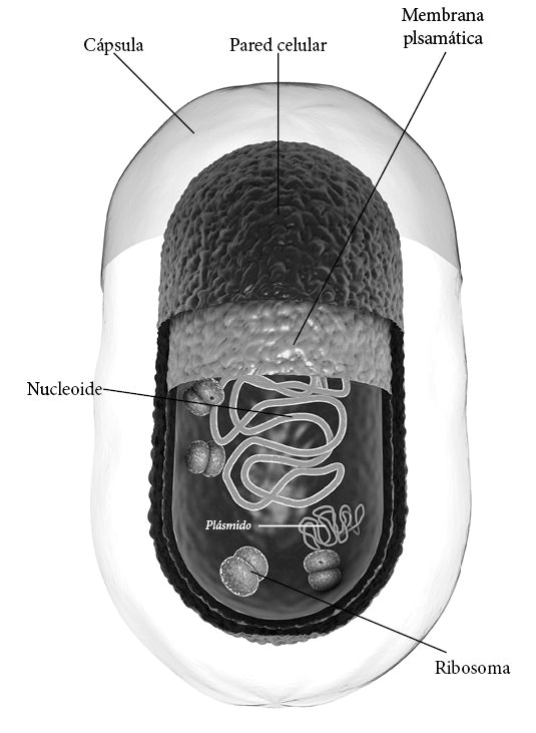
Esquema de una bacteria
Plásmidos
Las bacterias poseen además unas herramientas especializadas en el intercambio de genes llamadas plásmidos, que son trozos de ADN que contienen mucha información —de genes— que permiten que las bacterias puedan hacer cosas muy diferentes. Juegan un papel clave en su adaptación a distintos ambientes y en su evolución. La inmensa mayoría de las bacterias tienen un único cromosoma que contiene toda su información genética vital —las instrucciones para que las bacterias sean lo que son—. Los plásmidos son como cromosomas, pero más pequeños. La información contenida en los plásmidos puede perderse si el plásmido sale de la bacteria o puede insertarse en el cromosoma y quedarse mucho tiempo o para siempre en esa bacteria. Los transposones (genes saltarines) se encargan de llevar genes de los plásmidos al cromosoma y viceversa; y para complicar más la cosa, otros elementos bastante inquietos dentro de las bacterias son los integrones, que llevan grupos de genes de un sitio para otro.
A veces incluso todo un plásmido puede insertarse en el cromosoma bacteriano. De esta manera las bacterias pueden intercambiar genes entre sus plásmidos y su cromosoma, y entre bacterias a través de esos plásmidos. El cromosoma sería como un disco duro con información guardada siempre en el mismo sitio —la bacteria— y los plásmidos serían como unas llaves USB que permiten pasar un poco de información a otros dispositivos —a otras bacterias—. El flujo de información genética se da a nivel microscópico, pero ocurre en todas partes, porque en todas partes hay bacterias y muchas tienen plásmidos. Los plásmidos serían como mochilas llenas de herramientas —genes—. Llevar encima estas mochilas de herramientas puede ser pesado para las bacterias si las herramientas que contiene ese plásmido no son útiles en el ambiente en el que vive la bacteria.
Imaginemos que una bacteria vive en un río de aguas cristalinas. Llevar una mochila cargada con herramientas que permiten a esa bacteria utilizar pequeñas cantidades de metales pesados para sobrevivir no sería muy práctico. La bacteria se desharía de ella porque sería un lastre. El plásmido se perdería y por lo tanto, los descendientes de esa bacteria tampoco lo heredarían. Imaginemos ahora que una bacteria vive en las aguas del río Tinto en Huelva. Esas aguas llevan metales pesados, por lo que tener un plásmido con genes para la utilización de metales pesados sería útil. La bacteria que tiene un plásmido con resistencia a metales pesados lo mantendrá en su interior porque en ese ambiente es útil llevarlo encima. Y su descendencia heredará una copia de ese plásmido.
Imaginemos ahora que una bacteria está en nuestro intestino y lleva un plásmido con genes de resistencia a los antibióticos. Si no tomamos antibióticos, la bacteria posiblemente preferirá deshacerse de ese plásmido porque no lo necesita. Sin embargo, cuando tomamos antibióticos ese plásmido será tremendamente útil para sobrevivir. Las bacterias que no lo tengan morirán y las que lo tengan se lo pasarán a su descendencia, con lo que habrá cada vez más bacterias resistentes a los antibióticos si los seguimos tomando. Esto es exactamente lo que ocurre con plásmidos que circulan en los brotes hospitalarios causados por bacterias resistentes. Las bacterias que llevan estos plásmidos sobreviven en los centros sanitarios desplazando a otras bacterias que no los llevan, apropiándose de todo el ambiente hospitalario, ya que es un ambiente donde hay muchos pacientes recibiendo antibióticos. Son los denominados clones resistentes dominantes. Llega un momento en el que todas las cepas que se aíslan de pacientes infectados llevan el mismo plásmido, ya que este ha logrado mantenerse y proliferar en ese hospital protegiendo a las bacterias que lo llevan dentro.
Mutaciones compensatorias
Llevar un plásmido supone una carga energética, ya que hay que poner a trabajar muchas moléculas para mantenerlo y copiarlo cada vez que la bacteria se divide. Algunas bacterias han encontrado la forma de compensar esa carga mediante mutaciones. Digamos que esas bacterias han aprendido a redistribuir su energía para mantener los plásmidos dentro de ellas en espera de que en alguna ocasión les sean realmente útiles. Esas mutaciones compensatorias disminuyen este coste, con lo que la bacteria podría seguir haciendo una vida normal, a pesar de llevar un plásmido muy pesado que solo es útil en algunas ocasiones.
A mediados de los años 90 ya se comenzó a observar que aparecían mutaciones que compensaban el coste de mantener los plásmidos y los genes de resistencia en las bacterias. Aunque no haya antibiótico, las bacterias resistentes con plásmido pueden crecer igual que las bacterias sensibles que no llevan el plásmido, con lo que la población de bacterias que llevan los genes de resistencia no disminuirá mucho ni muy rápido, aunque dejemos de usar el antibiótico. De pesadilla.
Sería interesante usar antibióticos que vayan dirigidos contra dianas en las que un mecanismo de resistencia pueda suponer un coste biológico mayor o que haga que las bacterias tengan una tasa de mutaciones compensatorias menor. En las bacterias hay unas 350 potenciales dianas para los antibióticos, la mayoría sin explotar.
¿De dónde han salido los plásmidos?
Los plásmidos, al igual que los genes de resistencia a antibióticos, ya estaban ahí, en la naturaleza. Al seleccionar a las bacterias que los llevan mediante antibióticos, también los hemos seleccionado a ellos, a un montón de plásmidos de resistencia, durante los últimos 70 años. Como los genes de resistencia a los antibióticos sirven a las bacterias para resistir a estos, si un gen de resistencia está en un plásmido, el mantenimiento del gen de resistencia hará que también se mantenga el plásmido que lo contiene. Cuando utilizamos antibióticos, se seleccionan los genes de resistencia y los plásmidos de resistencia que contienen esos genes.
Algunas de las investigaciones con plásmidos más interesantes sobre esta cuestión surgieron de los trabajos pioneros de dos brillantes investigadoras británicas del Departamento de Bacteriología de la Real Escuela Médica de Posgrado de Londres, Victoria Hughes y Naomi Datta. La base de sus trabajos es el laborioso trabajo de Everitt George Dunne Murray (Johannesburgo, Sudáfrica, 1890). El Dr. Murray tuvo una vida dedicada a los microbios, plagada de estudios y premios, que transcurrió por muchos países como Inglaterra, Francia, India y Canadá. En 1930 se unió a la Universidad McGill (Montreal, Canadá) donde fue profesor y director del Departamento de Bacteriología e Inmunología. Durante su larga trayectoria, este investigador amasó una colección de bacterias recolectada y conservada entre 1917 y 1954. Su trabajo fue continuado por su hijo Robert Everitt George Murray. A esta colección se la denomina la colección Murray o simplemente la Colección, lo que ya nos indica su importancia.
Lo más interesante de la Colección es que alberga bacterias —y sus plásmidos— aisladas antes de que se comenzaran a utilizar antibióticos convencionales, incluida la penicilina —descubierta en 1928—. Estudiando esas bacterias antiguas y sus plásmidos podemos saber cómo han cambiado respecto a otras aisladas en la actualidad, y podemos también saber cómo han influido los antibióticos en el aumento de los genes de resistencia y de los plásmidos que los contienen. La colección incluye 683 bacterias, de las cuales ya se han secuenciado al menos 370 genomas completos. También se han aislado plásmidos de 489 de ellas. Esta colección de plásmidos es la que utilizaron Victoria Hughes y Naomi Datta para sus investigaciones. Los trabajos de estas brillantes investigadoras demostraron que el número de plásmidos con genes de resistencia en las bacterias de la era preantibiótica era muy pequeño, pero que su número aumentó rápidamente tras la introducción de los antibióticos. Básicamente, los plásmidos originales se fueron llenando de genes de resistencia a medida que las bacterias se exponían a los antibióticos. Y como eran plásmidos que podían pasar de unas bacterias a otras, los genes de resistencia fueron repartiéndose por todo el planeta haciéndose cada vez más numerosos, sobre todo en las bacterias con importancia en medicina humana.
Pero lo peor de todo no es solo que los plásmidos transmitan las resistencias a los antibióticos, sino que también se han acostumbrado a llevar y almacenar factores de virulencia en ellos. Esos factores de virulencia hacen a las bacterias más "malas", más virulentas, por lo que durante una infección con una bacteria que lleva un plásmido con resistencia y factores de virulencia, el enfermo lo tendrá más difícil para sobrevivir. Lo más curioso del tema de los plásmidos es el modo en que se transmiten. Las bacterias necesitan una especie de sexo mediante el cual se pasan un plásmido de una bacteria donadora a una receptora. Así de simple. La bacteria donadora que tiene el plásmido fabrica una estructura en forma de tubo con el que alcanza a la bacteria receptora y le trasmite su plásmido. El plásmido va desde el citoplasma —el interior— de la bacteria donadora hacia la otra célula, atravesando el conducto creado para tal efecto, hasta que llega al citoplasma de la otra célula y allí comienza también a realizar sus funciones. Las bacterias son muy fascinantes y lo curioso es que, aunque no sienten ni padecen, no tienen sexo con cualquiera. Por ejemplo, no pueden tener sexo para trasmitir plásmidos si en la bacteria receptora hay ya un plásmido que es incompatible con el de la donadora. Muy curioso. Quizás si conseguimos descubrir alguna molécula que impida que las bacterias tengan sexo —una especie de preservativo molecular— a lo mejor conseguimos que la tasa de transferencia de genes de resistencia mediante plásmidos se elimine, o por lo menos que se ralentice a escala global.
Vesículas
El tercer mecanismo —que todavía es objeto de debate— de transmisión de genes entre bacterias parece ser la producción y emisión de vesículas —pequeñas esferas— cargadas de mercancías e información genética. ¿Cuánto mide una bacteria?: una MICRA. Es una cifra fácil de recordar ya que estos MICROorganismos son MICROscópicos. Sabemos que los hay de muchos tamaños diferentes, pero una micra es un tamaño medio que sirve de buen ejemplo. Una micra —o micrómetro— es la milésima parte de un milímetro. Grosso modo un milímetro es la mitad de lo que mide de ancho un alfiler. Pues bien, la mayoría de las bacterias —si no todas — construyen en su interior y exportan al exterior vesículas de entre 10 y 250 nanómetros de diámetro. Un nanómetro es la milésima parte de una micra. Para ver estas vesículas necesitamos microscopios electrónicos muy potentes. Se sabe que estas pequeñas esferas contribuyen a distintas tareas: comunicación entre bacterias, formación de biocapas, defensa celular, virulencia, y también a la transmisión horizontal de genes.
La revista Science publicó en 2014 un artículo sorprendente. Analizando estas pequeñas vesículas que producía una especie de cianobacteria marina —Prochlorococcus—, descubrieron que casi la mitad de su genoma estaba empaquetado en trocitos dentro de estas vesículas y que esas vesículas eran liberadas durante el crecimiento de la bacteria. Es como si esta especie de bacteria estuviera liberando instrucciones en el océano para que en otra parte se pudiera volver a reconstruir esa bacteria completa.
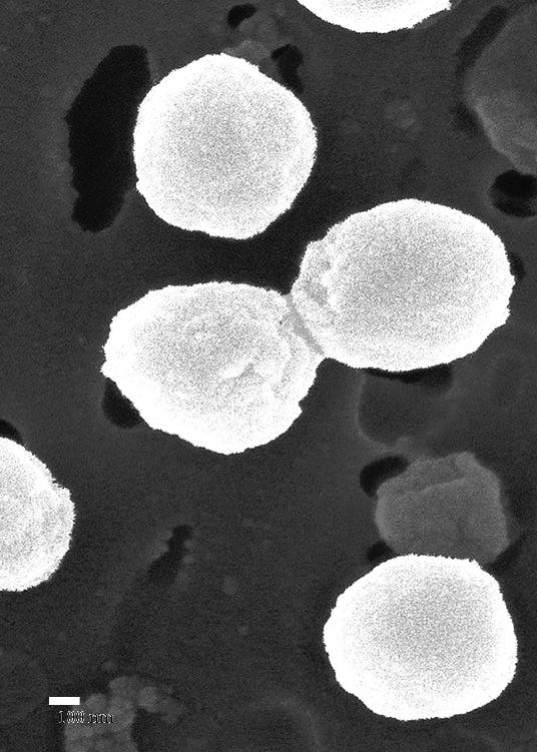
La cianobacteria Prochlorococcus
Por cada célula de Prochlorococcus que pusieron a crecer, apareció una media de 10 vesículas. Un cultivo en el laboratorio puede contener más de 10.000.000.000 bacterias. Si uno tiene mucha imaginación, podría llegar a visualizar la cantidad de vesículas con trozos de genes de bacterias que están flotando en las aguas de todos los océanos. Genes que pueden llegar a otras bacterias. Es la naturaleza en estado puro, salvaje y a lo Big Data. ¿Ese sistema de información es una forma de comunicación entre bacterias? Podría ser útil conocerlo más a fondo. Lo más sorprendente y desconcertante es que ya se han descubierto genes de resistencia a los antibióticos dentro de vesículas aisladas de patógenos ESKAPE (Enterococcus faecium, Staphylococcus aureus, Klebsiella pneumoniae, Acinetobacter baumannii, Pseudomonas aeruginosa, y Enterobacter spp).
Un aspecto crucial para la comprensión de los mecanismos de fabricación de antibióticos, o de resistencia a esos antibióticos, es entender también la comunicación bacteriana. Las bacterias se comunican principalmente haciendo quórum. Según la Real Academia Española, quórum es el «número de individuos necesario para que un cuerpo deliberante tome ciertos acuerdos». Para los microbiólogos, el quórum es el número de bacterias necesario para formar grupo que tome decisiones y haga cosas; es decir, las bacterias empiezan a crecer y multiplicarse y cuando llegan a un cierto número, comienzan a hacer cosas que no podrían hacer antes de llegar a ese número, cuando eran pocas. En grupo pueden producir factores de virulencia, o formar biocapas, o desplazarse en masa, o incluso producir metabolitos raros o antibióticos. Parece que cuando las bacterias son muchas se sienten animadas a hacer cosas que de forma individual no harían. Es lo que se denomina quórum sensing —algo así como percepción de quórum—, una forma de comunicación bacteria que está siendo muy estudiada por los científicos.
En el universo microscópico de una gota de agua, de la orilla de un lago, del océano o en la vegetación de la selva amazónica, hay una gloriosa y abrumadora red de señales químicas y genéticas entre microorganismos que podrían ser clave para comprender los mecanismos que regulan la producción de nuevos antibióticos. Veamos.
Las ciudades de las bacterias
La mayoría de las bacterias no se encuentran en la naturaleza de forma individual. Normalmente forman grupos bien organizados y adheridos a superficies naturales o artificiales por todo el planeta. Estos grupos bien organizados y compactos se denominan biocapas o biopelículas (del inglés biofilm), en las que millones de bacterias están unidas entre sí y a esas superficies naturales o artificiales mediante una especie de masa o cemento que se denomina matriz. En la naturaleza hay muchos tipos de biocapas. Un conocido ejemplo de biocapa es el sarro dental, que no es más ni menos que un conjunto brutal de bacterias —vivas y muertas, muchas de ellas anaerobias— que ha sufrido procesos de mineralización junto a pequeños restos procedentes de los alimentos. Cuando hablamos de pacientes, cualquier objeto inanimado que se inserta o implanta en el cuerpo humano —como un catéter o una prótesis de cadera—representa una superficie ideal para la colonización por bacterias y para la formación de una biocapa.
Las biocapas pueden estar compuestas por bacterias de una sola especie o por bacterias de varias especies, y pueden formarse en multitud de superficies. Dos ejemplos de patologías que implican la formación de biocapas son la fibrosis quística, donde Pseudomonas aeruginosa forma estas estructuras en el pulmón; y la otitis media, donde Haemophilus influenzae también las puede formar en el oído. En el caso de Pseudomonas, se cree que las biocapas que forman son en buena parte responsables de que las bacterias resistan a los tratamientos con antibióticos en los pulmones; y en Haemophilus serían responsables de las infecciones recurrentes en el oído. Una vez formada, la biocapa actúa como una especie de falange espartana que resiste los ataques del sistema inmunitario y de los antibióticos, por lo que en muchos casos esos implantes o prótesis dentro del cuerpo tienen que ser retiradas.
Según el Centro de Control de Enfermedades (CDC) y los Institutos Nacionales de la Salud (NIH) de Estados Unidos, las biocapas hacen que las bacterias de su interior sean entre 500 a 1.000 veces más resistentes a los antibióticos y a los desinfectantes.
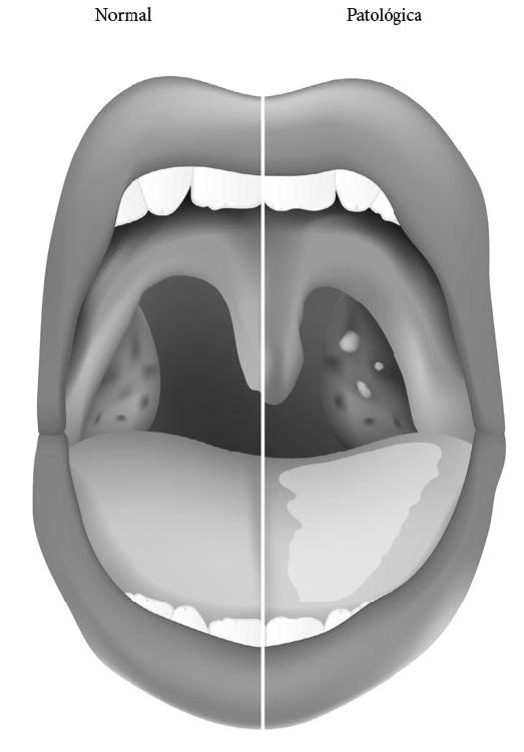
Aspecto esquemático de una boca normal (a la izquierda) y otra con la clásica amigdalitis por patógenos bacterianos, mostrando cambios en el aspecto de la lengua, inflamación en el itsmo de las fauces y pequeñas «placas» en la amígdala palatina derecha
Un "simple" dolor de garganta
Supongamos que usted comienza a sentir un dolor en la garganta; tiene una infección y esa infección está haciendo que le duela la cabeza. Comienza entonces a tomar un analgésico como paracetamol o ibuprofeno. Pasan los días y su dolor de garganta y de cabeza persiste o aumenta. Tiene molestias incluso a la hora de tomar alimento. Decide ir al médico. El médico le recibe y le examina la garganta. Aparentemente usted tiene placas producidas por una infección bacteriana, por lo que su médico de cabecera le receta un antibiótico. También le receta un analgésico como el que ya conocía, que debe seguir tomando mientras el dolor de cabeza o la inflamación de garganta persista. Supongamos que la posología de ese antibiótico —es decir, la cantidad y tiempo que tiene que tomar ese medicamento— es de 1 pastilla después de cada una de las 3 comidas del día, durante 10 días. Treinta pastillas. Tome el analgésico solo si realmente le duele la cabeza o la garganta. Todo bien indicado en la receta.
Usted va a la farmacia con su receta y le venden el antibiótico. Empieza el tratamiento. En el momento que comienza a introducir un antibiótico en su organismo, este actúa matando a las bacterias malas —y su médico conoce bien qué tipos de bacterias pueden causar ese tipo de infecciones de garganta—. Por eso le ha recetado ese antibiótico en concreto. Si usted hubiera tenido una infección de orina o en la piel, posiblemente le habría recetado otro distinto. Pero en nuestro cuerpo hay más de mil especies de bacterias distintas, sobre todo en el tubo digestivo, así que ese antibiótico comienza a actuar no solo contra las bacterias que están causando infección en su garganta, sino también contra millones de bacterias que hay en otras partes de su cuerpo. Y muchas de ellas son amigas suyas y por lo tanto buenas. Cuando usted lleva 3 días de tratamiento, comienza a notar mejoría. Ya no le duele apenas la cabeza y su garganta se encuentra mucho mejor. El antibiótico está haciendo efecto; ha matado a muchas de las bacterias malas que le estaban causando dolor e inflamación en la garganta y el dolor de cabeza. Si la intensidad de las molestias en la garganta es directamente proporcional al número de bacterias que la están causando, al reducirse el número de bacterias malas se reduce el dolor. Cuando lleva 5 o 6 días de tratamiento, deja de tomar ibuprofeno o paracetamol porque la cabeza ya no le duele o su garganta ha mejorado del todo. El antibiótico ha matado al 99 % de las bacterias malas. Pero por otra parte, usted ha comenzado a sentirse mal del estómago y ha comenzado a padecer diarrea o estreñimiento —efectos secundarios muy comunes de algunos antibióticos—. Como usted no se había leído el prospecto del medicamento, estos efectos secundarios le pillan por sorpresa. Quizás es hora de que los prospectos de los antibióticos pongan algo así como este medicamento va a matar a 100.000.000 de bacterias de su intestino grueso. No se queje, algunos efectos secundarios de antibióticos pueden —en contadas ocasiones— ser incluso peores: dañan riñones, provocan la caída de dientes o la rotura de tendones, etc.
Ese dolor de tripa se debe a que durante 5 días ha estado matando a las bacterias malas de su garganta, pero ha estado eliminando también a buena parte de su microbiota intestinal. Esta microbiota intestinal juega un papel fundamental en su estabilidad digestiva —en realidad, en la estabilidad de todo el cuerpo—. La mayoría de bacterias de su tubo digestivo no tienen genes de resistencia a antibióticos y mueren, dejando un espacio vacío que pueden ocupar bacterias que sí tienen algún gen de resistencia —que también las hay— y que ahora podrían multiplicarse cómodamente, porque el antibiótico ha eliminado a sus competidoras sensibles. Por lo tanto, las escasas bacterias que por mutación habían conseguido un gen de resistencia y malvivían en sus intestinos podrían comenzar a ser multitud, ya que el antibiótico no les hará nada. Las mutaciones son raras, pero en una población de pequeños individuos que se dividen cada 20 minutos y que en unas pocas horas son miles de millones la probabilidad de que una mutación aparezca en un gen y haga que se cree una resistencia a un antibiótico no es lo suficientemente baja para tener que estar 100 % tranquilos.
Si la bacteria causante de la infección de garganta era ya resistente al antibiótico, usted no se curará, ni a los 5 días ni a los 10, y entonces su destino es seguir sufriendo la infección y volver otra vez al médico para decirle que el tratamiento no ha funcionado, y que el dolor ha ido a peor. Entonces, su médico le recetará otro antibiótico diferente —y posiblemente más potente— para que se cure.
Volviendo al transcurso de su infección de garganta. Supongamos que no está causada por bacterias previamente resistentes al antibiótico y que este acaba con el 99 % de esas bacterias malas. Esto es suficiente para que deje de molestarle la garganta. Han pasado 5 días y le quedan la mitad de las pastillas en la caja. Usted tiene dos opciones: dejar de tomar el antibiótico porque cree que ya está curado de la garganta —y además le está haciendo daño al estómago—; o hacer caso a su médico y terminar el tratamiento, otros 5 días tomando el antibiótico y aguantando el dolor de estómago. Si usted elige la opción A, dejar de tomar el antibiótico, muy posiblemente no ha terminado de eliminar a todas las bacterias malas de su garganta —en nuestro caso le quedan aún un 1 %—con lo que podría volver a tener la misma infección antes o después, en el mismo sitio o en otro distinto de su tracto respiratorio. Simplemente, la garganta ya no le duele porque ha eliminado a la gran mayoría de bacterias malas que juntas estaban causando la formación de placas e induciendo el dolor.
Ese 1 % restante —que podrían ser persistentes o insensibles al antibiótico— comienzan a estar en contacto con una cantidad cada vez menor de antibiótico —ya que al abandonar el tratamiento, la concentración en sangre deja de ser suficiente—, por lo que sobreviven sin problemas. Aunque sean pocas, si el sistema inmunitario no las elimina podrían reanudar su crecimiento, el dolor de garganta y de cabeza volverían a aparecer y sería necesaria una nueva visita al médico.
Los antibióticos suelen atacar a las bacterias cuando se están dividiendo activamente, pero las bacterias persistentes están como dormidas, no se dividen, y por eso son menos sensibles a los antibióticos. Son pocas —sobre el 0,1 %— pero al no ser eliminadas podrían volver a crecer. Las bacterias de esas poblaciones que toleran los antibióticos, aunque son pocas, pueden estar implicadas en infecciones crónicas o recurrentes. En las infecciones crónicas hay más probabilidad de que tomemos antibióticos durante más tiempo, y también hay más probabilidad de que aparezcan más mutaciones en los cromosomas de las bacterias que pasan mucho tiempo con nosotros. Además, algunas enfermedades crónicas como la diabetes o la enfermedad pulmonar obstructiva crónica, aumentan el riesgo de padecer enfermedades agudas como la neumonía y, por lo tanto, el riesgo de ingresar en un hospital —o lo que es peor, en una UCI— es alto. Si padecemos una enfermedad crónica debemos cuidarnos más y debemos protegernos más, por ejemplo mediante vacunas.
Su médico le había dicho que tomase el antibiótico durante 10 días porque sabe que es el tiempo necesario para eliminar a todas las bacterias malas causantes de esas placas. Al tener una concentración eficaz de antibiótico en sangre solo la mitad del tiempo (5 de 10 días), las bacterias pueden terminar por hacerse resistentes o cambiar y volverse más agresivas. Los antibióticos, aunque sea en pequeñas dosis, son agentes muy estresantes para las bacterias. Cuando un ser humano o un animal están estresados, están nerviosos y pueden hacer cualquier cosa. Las bacterias también; cuando se estresan comienzan a hacer cosas que antes no hacían y algunas de esas cosas pueden ir en contra del paciente.
En este caso el refrán —lo que no te mata te hace más fuerte— está muy bien aplicado a la combinación «dosis subletal de antibiótico y estrés bacteriano».
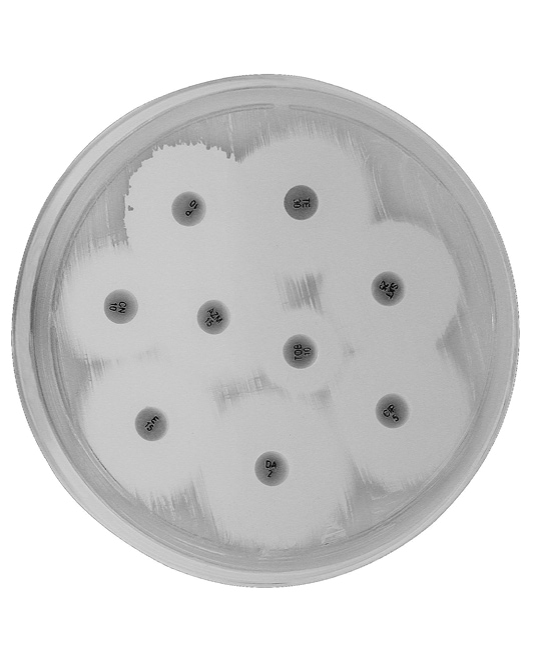
Antibiograma que muestra sensibilidad del Staphylococcus aureus en una placa de Petri.Los pequeños discos, marcados con códigos alfanuméricos, están bañados en sustancias antibióticas que se perfunden en el agar. Cuando la bacteria «problema» es sensible a este antibiótico, no puede prosperar y no crecen las colonias, apareciendo estos halos circulares
Si usted elige la opción B —terminar el tratamiento que le ha indicado su médico— eliminará prácticamente todas las bacterias malas de su garganta (100 %), seguirá durante unos días con dolor de estómago y seguirá matando miles de millones de bacterias buenas de sus intestinos. Pero, posiblemente, esas bacterias malas no volverán a aparecer por su garganta —al menos a corto plazo— y su flora intestinal se recuperará pronto. Los efectos secundarios de los antibióticos son un precio que hay que pagar por eliminar bacterias patógenas que pueden causar daños aún peores.
¿Qué va a hacer usted la próxima vez que tenga que tomar un antibiótico?
La mejor opción es claramente la opción B, pues si no termina el tratamiento que le indica su médico, las bacterias malas y peligrosas de su garganta no solo no habrán muerto totalmente, sino que tarde o temprano podrían volver a causarle una infección en el mismo sitio o en otro diferente. Hay que eliminarlas y la única manera efectiva es tomando el tratamiento completo, es decir, aunque tenga que pasar un dolor de tripa durante unos días. Es mejor no arriesgarse a que la siguiente infección por las bacterias malas no pueda curarse con ese antibiótico y necesitemos otro distinto, a lo mejor con peores efectos secundarios. En nuestro intestino —y sobre todo en nuestro colon—hay miles de millones de bacterias. La gran mayoría —el 99,99 % o más— no tienen genes de resistencia. Pero un pequeño porcentaje sí. Aunque solo sea una, esa bacteria está compitiendo contra millones de bacterias por los nutrientes que tenemos en nuestro tubo digestivo. Si con el antibiótico matamos a muchas de sus competidoras, estamos favoreciendo que esa única bacteria pueda alcanzar los recursos que le permitan dividirse. Cada vez que se divide crea copias de sí misma y del gen o genes de resistencia que tiene, con lo que su descendencia también podrá dividirse sin problemas en un ambiente en el que el antibiótico está eliminado a sus competidoras.
A medida que avanza el tratamiento con el antibiótico —esos 10 días en nuestro ejemplo— cada vez más bacterias sensibles se mueren en nuestros intestinos y cada vez más bacterias resistentes ocupan su lugar. No se preocupe, cuando deje de tomar el tratamiento antibiótico el equilibrio se restablecerá; la presión selectiva que estaba ejerciendo el antibiótico dejará de actuar y las bacterias sensibles volverán a tomar el control de sus intestinos tarde o temprano, con lo que sus digestiones volverán a la normalidad. No tenga miedo de las bacterias resistentes que ha seleccionado el antibiótico en sus intestinos. Son las de siempre, sus amigas, no le harán daño. Ya las tenía ahí, simplemente que ahora unas cuantas más tienen una carga genética especial bastante peligrosa.
Puede ocurrir que esas bacterias resistentes seleccionadas por el antibiótico que pertenecen a una especie en concreto puedan pasar los genes de resistencia a bacterias de otras especies distintas, con lo cual la próxima vez que tome el antibiótico este comenzaría ahora a seleccionar bacterias resistentes de dos especies distintas. Esta segunda especie que ha adquirido genes de resistencia de la primera podría pasar a su vez esos genes de resistencia a una tercera especie y así sucesivamente. Al final, podría haber muchas bacterias de muchas especies distintas con capacidad para resistir al antibiótico. Cuantos más antibióticos tomemos, peor: estaremos seleccionando más bacterias resistentes.
¿Se quedan esas bacterias resistentes, seleccionadas por el antibiótico, en nuestros intestinos?
Todos sabemos lo que pasa cuando vamos al baño a «expulsar lo que queda después de procesar el alimento». A medida que el alimento es procesado, los músculos de nuestro tubo digestivo hacen que los residuos vayan descendiendo tranquilamente hasta el recto y el ano. El proceso lleva unas horas, durante las cuales las paredes de nuestros intestinos absorben hasta el último nutriente útil de los alimentos ingeridos; no importa que sea carne, pescado, ensalada, tomates, fruta o pasteles; todo irá convirtiéndose lentamente en una masa homogénea, inútil y olorosa. A medida que el alimento procesado va siendo extruido y desciende, va arrastrando millones de bacterias presentes en las paredes del intestino; tras el proceso de extrusión, este alimento digerido abandona nuestro cuerpo cayendo hacia el retrete.
Cada vez que vamos al baño a expulsar lo que queda después de procesar el alimento, estamos expulsando también miles de millones de bacterias de muchas especies diferentes. Estas bacterias son nuestras amigas íntimas y si no cerramos la tapa del retrete cuando tiramos de la cadena, muchas de ellas pasarán a ser las amigas íntimas de nuestro aseo, ya que es inevitable que miles de microgotas salpiquen nuestro cuarto de baño durante el proceso. Algunas podrían llegar hasta su maquinilla de afeitar, su cepillo de dientes o hasta sus lentillas. Muchas más llegarán vivitas y coleando hasta las alcantarillas. Millones desde nuestro inodoro, decenas de millones desde nuestro edificio, miles de millones desde nuestra urbanización, innumerables desde nuestra calle o ciudad. No perdamos de vista esto: miles de millones de bacterias procedentes de nuestros intestinos van a parar a las alcantarillas, y de ahí a los ríos, etc.
Algunos científicos han hecho la prueba. La verdad es que desde el experimento de Barry Marshall y Robin Warren, con el que descubrieron que una bacteria, el Helicobacter pylori, —y no el estrés o los factores ambientales— causaba gastritis y úlcera péptica, no se había visto nada tan curioso. Cuando Marshall y Warren confirmaron que era una bacteria y que se podía eliminar con antibióticos, todos los médicos dejaron de recetar ansiolíticos para el estrés y comenzaron a recetar antibióticos contra la bacteria, con lo que Helicobacter se hizo cada vez más resistente a esos antibióticos. Es importante recordar este dato: cuando vamos al baño, muchas bacterias van a parar a las alcantarillas. En 200 gramos de heces humanas puede haber hasta 400 especies distintas de bacterias. Millones de bacterias de cada una de esas especies. Por supuesto, si tomamos antibióticos, muchas serán resistentes y llevarán consigo los genes que las hacen resistentes, que pueden pasar de unas bacterias a otras y de unas especies a otras. Y lo malo es que, como hemos visto, las bacterias resistentes perduran bastante en nuestros intestinos, incluso después de que dejemos de tomar el antibiótico.
Los genes de resistencia no se pierden de un día para otro, aunque a las bacterias que los lleven ya no les resulten útiles, pues su única función muchas veces es resistir al antibiótico. Podríamos decir que, cuando terminemos el tratamiento antibiótico, también se terminarán las bacterias resistentes, pero no es tan fácil. En nuestro ejemplo, llevaremos las bacterias resistentes en nuestro intestino mucho tiempo; además, las seguiremos expulsando cada vez que vayamos al baño. Y lo peor de todo es que, si esas bacterias mueren —que lo harán tarde o temprano—, sus genes de resistencia seguirán ahí, porque el ADN es una de las moléculas más estables de la naturaleza. No solo seguirán ahí los genes de resistencia, sino que serán susceptibles de ser captados por otras bacterias aunque su recipiente haya muerto. Las bacterias son así de especiales, pueden coger genes del ambiente, genes procedentes de los cadáveres de otras bacterias.
© 2024 JAVIER DE LUCAS